Цвета проводов в электрике: значение, маркировка
Каждый провод имеет маркировку и цветовое обозначение. Это необходимая мера, которая позволяет унифицировать электрическую продукцию, а также облегчает работу с ней. Нормы и требования к обозначениям проводов описаны в правилах устройства энергоустановок (ПУЭ). Это документ, по которому ориентируются электромонтажники.
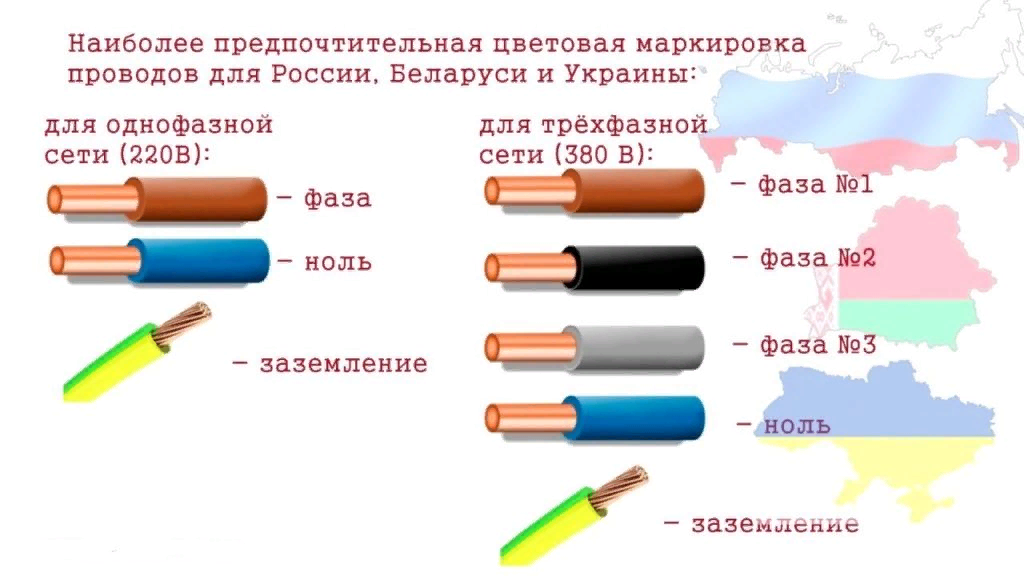
Маркировка сетей 220в и 380в в однофазном и трехфазном исполнении
Стандарты к маркировке проводов переменного тока для однофазной или трехфазной сети идентичны. Они совпадают по цвету ноля и заземления. Окрас фазного провода может совпадать или дополняться другими цветами.
Цветовая маркировка выполняется по длине проводника. Допускается идентификация на концах жил и в точках соединений, применяются цветные термоусадочные трубки (кембрики) или цветная изолента.
Чтобы распознать фазу, ноль или землю, необходимо зачистить кабель от верхней изоляции на 5 — 10 см, чтобы внутренние жилы остались в своей оплетке. По их цвету определяют назначение провода:
По их цвету определяют назначение провода:
- Заземление. Используют изоляцию, окрашенную в ярко желтый и зеленый цвет. При этом цветовые полоски могут быть нанесены как продольно, так и поперечно. Иногда встречаются провода с полностью зеленой или желтой изоляцией. Это также говорит о том, что данная жила идет на землю.
- Нолевой провод. Нейтральный провод окрашивают в голубой или синий цвет. Стандарты предусмотрены в ПУЭ.
- Фаза. В зависимости от количества фаз в электросети, провода окрашивают в цвета:
- Красный.
- Черный.
- Коричневый.
- Серый.
- Оранжевый.
- Белый.
- Бирюзовый.
- Фиолетовый.
- В электротехнике фаза имеет красный, черный или белый окрас.
ВНИМАНИЕ: Стандарты ПУЭ действуют в электротехнике и электрических приборах на территории России, Украины и Белоруссии. В других странах может быть своя маркировка, а также иные символьные обозначение. Изделие, не предназначенное для реализации на территории России и стран СНГ, стоит проверять согласно инструкции по эксплуатации, либо методом «прозвона» с помощью мультиметра.
Буквенное обозначение
Стандарты ПУЭ также включают в себя буквенное обозначение проводов. Для сети переменного тока 220В или 380В провода маркируют:
- Земля — «РЕ».
- Ноль — «0» или «N».
- Фаза — «L».
Для многофазного кабеля указывают провода в последовательности от L1 до Ln, где N — это количество фаз. Маркировка и цвет провода может отличаться от указанных стандартов.
Варианты расцветки проводов, а также ошибки при коммутации
Цветовой окрас и маркировка проводов может отличаться от современных стандартов ПУЭ из-за:
- Маркировка PEN. Распространенный случай. Ее можно обнаружить на старых проводах и схемах разводки электричества. Речь идет о системе заземления TN-C. Она предполагает объединение двух жил провода — заземления и ноля. Схема удобна для монтажа, но опасна в плане короткого замыкания. Провода системы TN-C имеют маркировку PEN. Единственная жила на ноль и землю окрашена в желто-зеленый цвет с ярко синими отметками на концах провода.

- Проводка, маркируемая согласно требованиям и стандартам других стран. Так в США маркировка ноля и земли может иметь другой окрас:
- Ноль — белый/серый цвет.
- Земля — оголенный медный/ зеленый/зелено-желтый/белый цвет.
- Проводка в некачественных или поддельных электрических изделиях. Продукция из стран третьего мира может иметь разную окраску. Рабочие на подпольных фабриках изготавливают проводку из того, что есть под рукой. Поэтому разбирать и ремонтировать такие изделия необходимо с особой осторожностью.
- Электрическая сеть, установленная не по правилам ПУЭ. К сожалению, такие случаи также бывают. Электрики самоучки, либо непрофессиональные специалисты делают разводку проводов «абы как». Неправильные подключения опасны, могут приводить к отказу электрооборудования, коротким замыканиям, ударам тока потребителя.
ВАЖНО: Некорректная коммутация проводов или путаница в маркировке влечет административную ответственность и штраф. Если вам установили некачественную проводку, в случае которой произошло короткое замыкание или выход из строя электроприборов, можно обратиться в суд.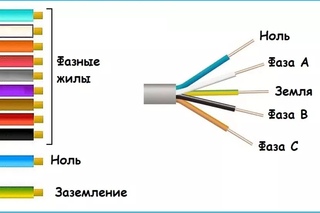 Судебный орган постановит возмещение убытков и наложение штрафа на недобросовестную компанию-монтажника.
Судебный орган постановит возмещение убытков и наложение штрафа на недобросовестную компанию-монтажника.
Чтобы быть уверенным, какая жила кабеля за что отвечает, необходимо знать методы определения. Для этого понадобятся базовые знание электротехники и минимальный набор индикаторных инструментов.
Как определить фазу, ноль и землю, если одноцветные провода не имеют маркировки
Часто определение провода визуальным способом не предоставляется возможным. Подобную ситуацию можно наблюдать при замене проводки в домах, построенных во времена СССР. Сняв розетку или выключатель, человек обнаруживает два или три провода одинакового белого цвета.
Для решения возникшего противоречия потребуется индикаторная отвертка или мультиметр.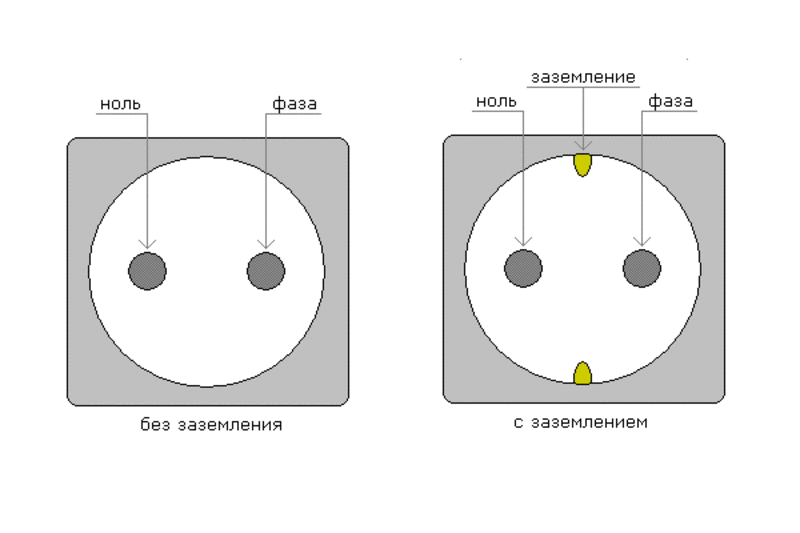 Первый инструмент позволит определить рабочие фазы под нагрузкой. Фазу и ноль ищут методом прикосновения отверткой к оголенному проводу. Если лампочка загорается — значит, данный провод находится под нагрузкой. Ноль не будет давать сигналов.
Первый инструмент позволит определить рабочие фазы под нагрузкой. Фазу и ноль ищут методом прикосновения отверткой к оголенному проводу. Если лампочка загорается — значит, данный провод находится под нагрузкой. Ноль не будет давать сигналов.
Для определения земли используют прибор — мультиметр. На нем выставляют значение переменного тока на отметку свыше 220В. Один из контактов инструмента прикрепляют к фазе, второй поочередно к оставшимся проводам. Ноль зафиксирует напряжение 220В или выше. Земля покажет значительно меньше 220В.
В новостройках устанавливают розетки с маркированными проводами, так как этого требуют СНиП 3.05.06-85 и ГОСТ 10434-82.
ВАЖНО: Будьте внимательны, когда отключаете бытовую электросеть у себя в квартире или доме для проверки проводов. Иногда автоматы в распределительном щитке устанавливают неверно. Их врезают в разрыв ноля, а не фазы — электроприборы в доме работать не будут, однако напряжение с фазы никуда не денется. Необходимо не только отключать автомат, но и смотреть изменение нагрузки на проводах внутри квартиры при помощи индикаторной отвертки.
Указанные методы позволяют определить провода в бытовой электрической сети переменного тока. Рассмотрим маркировку кабелей постоянного тока.
Расцветка проводов в сети постоянного тока
В сети постоянного тока используют только две жилы:
- Положительную шину (обозначается «+„).
- Отрицательную шину (обозначается “-»).
По нормативным документам, провода и шины положительного заряда окрашивают в красный цвет, а провода и шины отрицательного заряда должны быть синего оттенка. Средний проводник (М) обозначают голубым цветом.
ИНФОРМАЦИЯ: В трехфазных сетях шины и высоковольтные ввода трансформаторов на электрических станциях и подстанциях окрашиваются: желтым цветом — провода и шины с фазой «A», зеленым — с фазой «B», красным — с фазой «C».
Заключение
Визуальное определение проводки — нехитрое дело. Главное знать, какой цвет за что отвечает. В целях безопасности, стоит проверять провода на наличие фазы и земли перед началом работ с ними. Неправильная коммутация жил провода может привести к короткому замыканию или выгоранию подсоединенного электрооборудования.
Расцветки проводки в Америке, Западной Европе. Частный электрик москвич
Какие цветовые коды оболочки
проводов используются для
обозначения в западных странах
при монтаже электропроводки
Кабели, провода, вся электропроводка,
с помощью которой производится электромонтажные
работы в доме, квартире в
электрощите, при монтаже
электроаппаратов имеет цветовую
маркировку. Цветовая маркировка
Цветовая маркировка
электропроводки при
распределении переменного и
постоянного тока какой-либо
ветви цепи обязательно имеет
цветовую маркировку.
В некоторых странах все цвета
проводов указаны в
нормативно-правовых документах,
в некоторых странах есть лишь
некоторые рекомендации по цвету
проводов для электромонтажа.
Посмотрим, какие правила
цветовой маркировки проводки, то
есть цвета изоляции провода,
существуют на Западе.
В Европе большинство стран
придерживается правил МЭК,
Международной Электротехнической
комиссии. Мы будем рассматривать
те правила, которые используются
для расцветки электропроводки
переменного тока.
Рассмотрим новые и старые
цветовые коды. Старая кодировка
не полностью учитывала точное
обозначение фаз. Электромонтажные
работы сейчас выполняются с
учетом новых правил цветовой
кодировки, а это более понятно и
удобно при электромонтаже.
Кстати, в Европе провод
защитного заземления везде
обозначается как зеленый с желтой полосой.
Цветовые коды электропроводки
МЭК, применяемые в большинстве
стран Европы:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Так обозначаются цвета
электропроводки в Европе.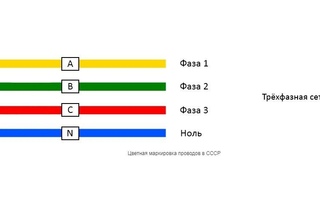 Если
Если
производится монтаж
электропроводки в доме с
трехфазным напряжением, то по
цвету провода можно понять какую
функцию выполняет провод, какая
это фаза или это ноль.
А вот в США цветовая маркировка
электропроводки отличается. Там
есть маркировка Национального
Электрического кода. Провод
заземления в Америке или медный
оголенный, без изоляции, или
зеленый, или зеленый с желтой
полосой. Цвета провода черный,
красный и синий используются для
электропроводки с трехфазным
переменным напряжением
120 вольт. Цветовой код
коричневый, оранжевый и желтый
используется для электропроводки
с более высоким переменным
напряжением.
Вот цветовые коды
электропроводки переменного
тока, используемые в США:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Так что в Штатах ноль в розетке
– белый провод, что для нашей
российской электропроводки в
доме не характерно.
Если вам нужно сделать
качественный монтаж
электропроводки в доме или
квартире, звоните. Я делаем
надежную электропроводку.
Маркировка проводов и кабелей согласно норм ПУЭ
Правильная маркировка проводов
Правильная маркировка проводов и шнуров позволяет значительно облегчить монтаж и ремонт любых электрических сетей. Ведь правильная маркировка не только облегчит сам процесс монтажа, но и позволит вам или любому другому человеку просто взглянув в распределительную коробку, щиток или на провода, определить их назначение.
Именно для этих целей маркировка проводов должна выполняться согласно единых правил, которые приведены в «Библии» любого электрика – ПУЭ (Правила устройства электроустановок).
Правила маркировки токоведущих частей согласно ПУЭ
Для обеспечения наглядности, простоты и облегчения распознавания отдельных частей электрической сети согласно п.1.1.30 ПУЭ все электроустановки должны иметь буквенно-цифровое и цветовое обозначение. Причем наличие одного из этих обозначений не снимает необходимость наличия другого.
И единственным послаблением является возможность нанесения обозначения не по всей длине проводника, а только в местах подключения, как представлено на видео.
Цветовая маркировка проводов
Маркировка проводов по цветам является наиболее наглядной и позволяет быстро определиться с назначением любого провода. Такая маркировка может быть осуществлена путем выбора проводов с соответствующим цветом изоляции жил, путем нанесения краски на шины или за счет окрашивания или применения специальной цветной изоленты в местах соединения жил.
Причем краска на шины может наносится не по всей длине, а только в местах подключения или по концам шин.
Обозначение фазных проводов
Итак:
- Если говорить о цветовом обозначении проводов и кабелей, то начать следует с фазных проводников. Согласно п.1.1.30 ПУЭ в трехфазной сети фазные проводники должны иметь маркировку желтым, зеленым и красным цветом. Так соответственно обозначаются фазы А, В и С.
- Инструкция для однофазной электрической сети предполагает обозначение фазного провода в соответствии с тем цветом, продолжением которой она является. То есть, если фазный проводник подключается к фазе «В» трехфазной сети, то он должен иметь зеленый цвет.
Обратите внимание! В однофазной сети квартиры или дома вы зачастую не знаете к какой фазе подключен ваш фазный провод. Дабы соблюдать ГОСТ вам совсем не обязательно это выяснять. Достаточно обозначить фазный проводник любым из предложенных цветов. Ведь для однофазной сети освещения совершенно не принципиально к какой именно фазе подключен ваш проводник. Исключение составляет только сеть освещения в которой используются два разных фазных проводника.
- Что же касается нулевых проводников, то они должны иметь голубую окраску. Причем цвет нулевой жилы не зависит от того трехфазная, двухфазная и однофазная сеть перед вами. Он всегда обозначается голубым цветом.
- Маркировка проводов с полосой желто-зеленого цвета обозначает защитный проводник. Он подключается к корпусу электроприборов и обеспечивает безопасность от поражения электрическим током при повреждениях изоляции электрооборудования.
Обозначение нулевых и защитных проводников
- Если нулевой и защитный проводник объединены, то согласно п.1.1.29 ПУЭ такая жила провода должна иметь голубой окрас с желто-зелеными полосами на его концах. Дабы выполнить такую маркировку своими руками достаточно просто взять провод голубого цвета и на его концевых заделках выполнить обозначение краской или использовать для этого цветную изоленту.
- Что же касается сетей постоянного тока, то красным цветом должна обозначаться положительная жила провода или шины, а отрицательная синим. При этом обозначение нулевой и защитной жилы соответствует маркировке в сетях переменного тока.
Буквенная маркировка проводов
Но маркировка проводов цветная не всегда удобна. В щитках, распределительных устройствах и на схемах значительно удобнее буквенное обозначение. Оно должно применяться совместно с цветовым обозначением.
Итак:
- Буквенная маркировка фазных проводов в трехфазной сети соответствует их разговорному обозначению – фаза «А», «В» и «С». Для однофазной сети она должна быть такой же, но это далеко не всегда удобно. Тем более что достоверно определить какая именно фаза не всегда возможно. Поэтому часто используют обозначение «L».
Обратите внимание! Пункт 1.1.31 ПУЭ нормирует не только буквенно-цветовое обозначение проводников, но и их расположение. Так для трехфазной сети при вертикальном расположении шин фаза «А» должна быть самой верхней, а фаза «С» нижней. А при горизонтальном расположении проводников ближайшая к вам должна быть фаза «С», а наиболее удаленная фаза «А».
- Если выполняется маркировка проводов в щитке, то под символом «N» обозначают нулевой провод.
- Для обозначения защитного провода применяют буквенное обозначение «PE». Кроме того, достаточно часто применяется знак заземления, но дело в том, что он не всегда может точно указать на схему сети.
На фото представлен знак заземления
- Дело в том, что вы можете встретить обозначение «PEN». Оно обозначает совмещение нулевого и защитного проводника. Это возможно в системах TN-C-S о которых мы говорили в одной из предыдущих наших статей.
- А вот маркировка проводов электрических постоянного тока выполняется символизмами «+» и «―». Что соответственно обозначает положительный и отрицательный провод. Для постоянного тока есть еще одно отличие. Нулевая жила обозначается символом «М», что иногда вводит в заблуждение.
Маркировка в сети постоянного тока
Не нормированные варианта обозначения проводов
Но к сожалению маркировка проводов фаза ноль, заземление далеко не всегда выполняется согласно норм ПУЭ. Часто можно встретить и другие обозначения. Особенно часто это касается старых схем, электрооборудования, а также некоторых новых устройств не сертифицированных производителей.
И дабы они не ввели вас в заблуждение давайте рассмотрим наиболее распространенные варианты.
- Достаточно часто на старых еще советских схемах можно встретить символы «Ф» или «Ф1», «Ф2» и «Ф3». Расшифровка данного обозначения достаточно проста – это обозначает фаза. Причем символ без буквенного обозначения применяется для однофазной сети, а с буквенных для трехфазной.
- На новых схемах можно встретить обозначение «L» или соответственно «L1», «L2» и «L3». Так зарубежные производители часто обозначают фазу. Что касается цифровых обозначений, то здесь действует то же правило – без цифры для однофазной сети, с цифрами для трехфазной.
Обратите внимание! Для однофазной сети обозначение «Ф» или «L» обозначают не принципиальность четкого соблюдения фаз. То есть вы можете подключить любую фазу. То же касается и трехфазной сети с цифровым обозначением. Если же имеется обозначение «Фа», «Фв», «Фс» или ««Lа», «Lв», «Lс», то соблюдение чередования фаз обязательно.
- Маркировка проводов в щитах может содержать символ «0». Это обозначение нулевого провода достаточно часто используют по сей день как в схемах, так и в обозначении выводов на оборудовании.
Пример нестандартного обозначения на схемах
- Для обозначения защитного провода часто используется символ заземления, о котором мы уже говорили выше. Обычно его применяют для обозначения места подключения защитного провода выполненных по системе отличной от TN-C-S.
- Маркировка проводов щитка постоянного тока может содержать символы «L+» и «L―». Данный символы обозначают соответственно положительный и отрицательный проводник и не должны вводить вас в заблуждение.
Вывод
Правильная маркировка проводов по цвету и обозначению способна во многом облегчить не только монтаж, но и последующее обслуживание электроустановок. Тем более что цена выполнения требований по маркировке крайне низка, а требования не так уж сложны к исполнению. Поэтому если вы хотите все сделать «по уму» и облегчить себе же дальнейшую эксплуатацию вашей электрической сети советуем вам соблюдать данные нормы.
Цвета проводов и другая маркировка в электрике: фаза, земля, ноль.
Сегодня все провода, используемые для прокладывания электрических сетей и подключения электрооборудования, окрашены в специальные цвета. Благодаря этому значительно упрощается обслуживание и замена проводов, а также выявление причин неполадок и поломок.
На первой же картинке ниже, мы представили самые популярные цветовые маркировки проводов. Эти цветовые решения могут не решить всех задач, по этому обязательно прочитайте всю статью целиком.
Цветовая маркировка проводов
Содержание:
Зачем нужна цветовая маркировка
Цветовая маркировка проводов в электрике является необходимостью, поскольку это значительно облегчает коммутацию и чтение электрических схем. Если рассмотреть в качестве примера схему подключения простого выключателя освещения, то может показаться, что маркировка не обязательна, поскольку все просто и понятно.
Простая проводка
Однако, если же мы возьмем в качестве примера схему подключения в сеть распределительного щитка с большим количеством дифференциальных автоматов и защитных устройств, то сразу заметим разницу.
Сложная проводка
Если бы не обозначение проводов по цвету, было бы очень сложно разобраться в том, какое устройство или кабель вышли из строя, и в какую цепь они включены.
Кроме того, когда провода окрашены в определенный цвет, значительно упрощается их монтаж, поскольку вероятность допустить ошибку и перепутать местами провода снижается. Если же мы, к примеру, перепутаем фазу и ноль при подключении устройств к электрическому щитку у себя в квартире, то это может привести к возникновению короткого замыкания, поломке оборудования или что еще хуже, поражению электрическим током.
Производители окрашивают провода кабелей в те или иные цвета не в случайном порядке, а согласно правилам электротехнических установок. В них точно описано, какая маркировка может использоваться для проводов в определенных условиях. Кроме того, 7 издание ПЭУ (от 2002 г.) предписывает идентифицировать кабели и провода согласно не только их цвету, но и символьным обозначениям.
На сегодняшний день в России принят единый стандарт цветовой идентификации проводов, согласно которому и должны выполняться все электротехнические работы с проводниками. Согласно этим требованиям, каждая жила проводов или кабелей должна иметь отдельный цвет. Чаще всего используют синий, зеленый, коричневый и серый, однако, при необходимости, применяются дополнительные цвета и оттенки. Рекомендуется делать маркировку различимой на всем протяжении проводника, но можно использовать и провода, у которых окрашен лишь край жилы. Для идентификации таких проводников на местах подключения устанавливаются цветные термоусадочные кембрики или изоляционная лента нужного цвета.
Ниже описано, какая маркировка применяется для отдельных типов проводов в зависимости от типа сети и оборудования.
Цвета проводов в трехфазной сети переменного тока
В трехфазных электросетях при подключении трансформаторного оборудования, подстанций и аналогичных электроустановок фазные шины окрашивают в определенный цвет согласно следующему правилу:
- фаза A – желтый;
- фаза B – зеленый;
- фаза C – красный.
В сетях постоянного тока
Несмотря на то что в большинстве случаев мы имеем дело с переменным током, электросети постоянного тока тоже имеют широкую сферу применения:
- В промышленной и строительной сфере – для работы электрических кранов, тележек и складского погрузочного оборудования.
- Для питания электротранспорта: троллейбусов, трамваев, электровозов, теплоходов, и т.д.).
- Для подачи нагрузки на оперативные защитные цепи и автоматическое оборудование электрических подстанций.
Как нам известно, кабель для проводки постоянного тока состоит из двух проводов, в отношении которых не используются такие понятия, как нулевая и фазная жила. В конструкцию кабеля входят лишь две шины с противоположным зарядом, которые иногда называют просто «плюсом» и «минусом».
Принятая маркировка проводов требует, чтобы плюсовой полюс в такой сети был обозначен красным, а минусовой – синим цветом. Нулевой контакт, обозначаемый на схемах М, окрашивается в голубой цвет.
Когда двухпроводная сеть подключается к трехпроводной, необходимо, чтобы цвета ее проводов или шин точно соответствовали цвету контактов питающей электросети, к которым они подсоединены.
Цветовая маркировка фазы, нуля и земли
Для разводки и монтажа электросетей на бытовых и на промышленных объектах, используют многожильные кабели, каждый провод внутри которых окрашен в отличительный цвет. Это необходимо, как уже было сказано, для упрощения монтажа и обслуживания сети.
Так, к примеру, если ремонт сети будет проводить человек, который не занимался её прокладкой, по цвету провода, подключенного к приборам и источникам питания, он сразу поймёт рабочую схему. В противном случае возникнет необходимость пробивать ноль и фазу вручную, используя пробник. Этот процесс непрост даже при проверке новых проводов, а при необходимости ремонта старой проводки и вовсе превратится в испытание, поскольку раньше, в советское время, маркировка проводов не осуществлялась, и все они были покрыты черной или белой изоляционной оболочкой.
Согласно разработанным стандартам (ГОСТ Р 50462) и правилам электротехнического монтажа, каждый провод, находящийся в кабеле, будь то ноль, фаза или земля, должен иметь свой цвет, который говорит о его назначении. Одним из главных требований электротехнических установок является возможность быстро и точно определить функцию провода на любом его участке. Лучше всего для решения этой задачи подходит именно цветовая маркировка.
Представленная ниже маркировка проводов разработана для сетей и электроустановок переменного тока (трансформаторы, подстанции и т.п.) с глухозаземлённой нейтралью и номинальным напряжением не более 1 кВ. Этим условиям соответствует большая часть жилых и административных зданий.
Защитный и рабочий нулевой проводник
Ноль или нейтраль на электротехнических схемах обозначается буквой N и окрашивается на всем протяжении в голубой или синий цвет без дополнительных цветовых обозначений.
PE – защитный нулевой контакт или просто «земля», имеет характерную окраску из чередующихся вдоль провода линий зеленого и желтого цвета. Некоторые производители окрашивают ее в однородный желто-зеленый оттенок по всей длине, но принятый в 2011 году ГОСТ Р 50462-2009 запрещает обозначать заземление желтым или зеленым цветом по отдельности. В сочетании зеленый/желтый эти цвета могут использоваться только в ситуации, когда обозначают заземление.
У PEN-проводов, используемых в устаревших на сегодня системах TN-C, где «земля» и ноль совмещены, более сложная маркировка. Согласно последним утвержденным стандартам, основная часть провода на всем протяжении должна быть окрашена в синий цвет, а концы и места соединения – желто-зелеными полосками. Возможно также применение проводов с противоположной маркировкой – провод желто-зеленого цвета с синими концами. Встретить такой провод в зданиях современной постройки можно редко, так как от использования TN-C отказались ввиду риска поражения людей током.
Резюмируя вышесказанное:
- ноль (нулевой рабочий контакт) (N) – провод синего или голубого цвета;
- земля (нулевой заземляющий) (PE) – желто-зеленый;
- совмещенный провод (PEN) – желто-зеленый с синими метками по концам.
Фазные провода
В конструкции кабелей может встречаться несколько токоведущих фазных проводов. Правилами электротехнических установок требуется, чтобы каждая фаза была обозначена отдельно, поэтому для них принято использовать черный, красный, серый, белый, коричневый, оранжевый, фиолетовый, розовый и бирюзовый цвета.
Когда проводится монтаж однофазной цепи, подключенной к трехфазной электросети, необходимо чтобы цвет фазы ответвления точно соответствовал цвету фазного контакта питающей сети, к которому она подсоединена.
Кроме того, стандартом предписывается соблюдать цветовую уникальность всех используемых проводов, поэтому фаза не может иметь такой же цвет, как ноль или земля. Для кабелей без цветовой идентификации маркировка должна быть проставлена вручную — цветной изоляционной лентой или кембриками.
Чтобы не столкнуться с необходимостью покупки термоусадочных трубок или изоленты уже во время монтажа (и не усложнить схемы лишними обозначениями), следует определиться с тем, какая комбинация цветов будет использована во всех электрических цепях дома, и закупить нужное количество кабелей каждого цвета до начала работ.
Нанесение маркировки на проложенный кабель
Электрикам нередко приходится сталкиваться с ситуацией, когда необходимо провести ремонт электрического щитка или сети, а оборудование соединено так, что не понятно, где расположены фаза и ноль, а где – земля. Это происходит, когда монтаж системы производится человеком неопытным, без специальных знаний, у которого не только маркировка, но и расположение кабелей внутри щита выполнено неверно.
Еще одной причиной возникновения таких проблем является устаревшая и неактуальная квалификация электриков. Работа выполняется правильно, но в соответствии со старыми нормативами, поэтому для специалиста, пришедшего «на замену», возникает необходимость «пробивать» с помощью инструмента, где расположен ноль, а где фаза.
Спорить о том, кто виноват, и стоит ли кому-либо заниматься самостоятельным ремонтом, не имеет смысла, лучше определиться с тем, как нанести правильную и понятную маркировку.
Итак, действующими стандартами установлено, что цветовая маркировка на электрических проводниках не обязательно может быть размещена на всем их протяжении. Разрешается обозначить её лишь в местах соединения и подключения контактов. Поэтому, при необходимости разметки кабелей без обозначений, следует купить набор термоусадочных трубок или изоляционной ленты. Количество цветов зависит от конкретной схемы, но желательно приобрести стандартную «палитру»: ноль – синий, земля – желтый, а на фазы — красный, черный и зеленый. В однофазной сети, естественно, фаза обозначается одним цветом, чаще всего – красным.
Использование цветной изоленты или термоусадочных кембриков подойдет и для ситуаций, когда имеющийся провод не соответствует требованиям ПЭУ. К примеру, при необходимости подключения четырехжильного кабеля в трехфазную сеть с проводами белого, красного, синего и желто-зеленого цвета. Данные провода можно подключить в любом порядке, но обязательно поставить кембрики или намотки из изоленты с «правильными» цветами в местах подключения.
Кроме того, следует помнить об описанных выше проблематичных ситуациях во время монтажа нового узла, или подключения оборудования. Отсутствие четких и понятных обозначений может значительно усложнить дальнейшее обслуживание схемы даже человеку, производившему её установку.
Если вы обнаружили, что в вашем распределительном щите или сети используются обозначения проводов, не соответствующие текущим требованиями, не стоит торопиться заменять их. До проведения ремонта или демонтажа на проводку распространяются нормативы, которые действовали на момент её прокладки. Кроме того, если сеть правильно функционирует, замена не требуется. А при вводе в эксплуатацию новой (или переделанной старой) электрической сети придется учитывать и соблюдать все современные требования и правила.
Цветовая маркировка проводов: фаза, земля, ноль
В большинстве современных кабелей проводники имеют изоляцию разных цветов. Цвета эти имеют определенное значение и выбираются не просто так. Что такое цветовая маркировка проводов и как с ее помощью определить где ноль и заземление, а где — фаза, и будем говорить дальше.
Содержание статьи
Зачем это надо
В электрике принято различать провода по цветам. Это намного облегчает и ускоряет работу: вы видите набор проводов разных цветов и, по цвету, можете предположить какой для чего предназначен. Но, если разводка не заводская и делали ее не вы, перед началом работ обязательно надо проверить соответствуют ли цвета предполагаемому назначению.
Цвета проводов имеют определенное значение
Для этого берут мультиметр или тестер, проверяют на каждом проводнике наличие напряжения, его величину и полярность (это при проверке сети электропитания) или просто прозванивают куда и откуда идут провода и не меняется ли «в пути» цвет. Так что знание цветовой маркировки проводов — один из необходимых навыков домашнего мастера.
Цветовая маркировка провода заземления
По последним правилам проводка в доме или квартире должна иметь заземление. Последние годы вся бытовая и строительная техника выпускается с заземляющим проводом. Причем заводская гарантия сохраняется только при условии подачи электропитания с работающим заземлением.
Чтобы не путаться для провода заземления принято использовать желто-зеленую окраску. Жесткий одножильный провод имеет зеленый основной цвет с желтой полосой, а мягкий многожильный — основное поле желтого цвета с зеленой продольной полосой. Изредка могут встречаться экземпляры с горизонтальными полосками или просто зеленые, но это — нестандарт.
Цвет провода заземления — одножильного и многожильного
Иногда в кабеле есть только ярко-зеленый или желтый провод. В таком случае именно их используют как «земляной». На схемах «земля» обычно рисуется зеленым цветом. На аппаратуре соответствующие контакты подписываются латинскими буквами PE или в русскоязычном варианте пишут «земля». К надписям часто добавляется графическое изображение (на рисунке ниже).
В некоторых случаях на схемах шина «земля» и подключение к ней обозначается зеленым цветом
Цвет нейтрали
Еще один проводник, который выделяют определенным цветом — нейтраль или «ноль». Для него выделен синий цвет (ярко-синий или темно-синий, изредка — голубой). На цветных схемах эта цепь также прорисовывается синим, подписывается латинской буквой N. Так же подписываются контакты, к которым необходимо подключить нейтраль.
Цвет нейтрали — синий или голубой
В кабелях с гибкими многожильными проводами, как правило, используется более светлые оттенки, а одножильные жесткие проводники имеют оболочку более темных, насыщенных тонов.
Окраска фазы
С фазными проводниками несколько сложнее. Их окрашивают в разные цвета. Исключены уже используемые — зеленый, желтый и синий — а все остальные могут присутствовать. При работе с этими проводами надо быть особенно аккуратными и внимательными, ведь именно на них присутствует напряжение.
Цветовая маркировка проводов: какого цвета фаза — возможные варианты
Итак, наиболее часто встречающаяся цветовая маркировка проводов фазы — красный, белый и черный. Еще могут быть коричневый, бирюзовый оранжевый, розовый, фиолетовый, серый.
На схемах и клеммах фазные провода подписываются латинской буквой L, в многофазных сетях рядом стоит номер фазы (L1, L2, L3). П кабелях с несколькими фазами они имеют разную окраску. Так проще при разводке.
Как определить правильно ли подключены провода
При попытке установить дополнительную розетку, подключить люстру, бытовую технику, требуется знать, какой именно провод является фазным, какой нулевым, а какой — заземляющим. При неправильном подключении техника выходит из строя, а неосторожное прикосновение к токоведущим проводам может окончиться печально.
Надо убедиться что цвета проводов — земля, фаза, ноль — совпадают с их разводкой
Проще всего ориентироваться по цветовой маркировке проводов. Но не всегда все просто. Во-первых, в старых домах проводка обычно однотонная — торчат два-три провода белого или черного цвета. В этом случае надо разбираться конкретно, после чего навешивать бирки или оставлять цветные метки. Во-вторых, даже если в кабеле проводники окрашены в разные цвета, и вы визуально можете найти нейтраль и землю, правильность своих предположений надо проверить. Случается, что при монтаже цвета перепутаны. Потому сначала перепроверяем правильность предположений, потом начинаем работы.
Для проверки понадобятся специальные инструменты или измерительные приборы:
- индикаторная отвертка;
- мультиметр или тестер.
Найти фазный провод можно при помощи индикаторной отвертки, для определения нуля и нейтрали нужен будет тестер или мультиметр.
Проверка с индикатором
Индикаторные отвертки бывают нескольких видов. Есть модели, на которых светодиод зажигается при прикосновении металлической частью к токоведущим частям. В других моделях для проверки требуется дополнительно нажать кнопку. В любом случае при наличии напряжения зажигается светодиод.
С индикаторной отверткой работать просто
При помощи индикаторной отвертки можно найти фазы. Металлической частью прикасаемся к оголенному проводнику (при необходимости наживаем на кнопку) и смотрим, горит ли светодиод. Горит — это фаза. Не горит — нейтраль или земля.
Работаем аккуратно, одной рукой. Второй к стенам или металлическим предметам (трубам, например) не прикасаемся. Если провода в проверяемом кабеле длинные и гибкие, можно придержать их второй рукой за изоляцию (держитесь подальше от оголенных концов).
Проверка с мультиметром или тестером
На приборе выставляем шкалу, которая немного больше предполагаемого напряжения в сети, подключаем щупы. Если позваниваем бытовую однофазную сеть 220В, ставим переключатель в положение 250 В. Одним щупом прикасаемся к оголенной части фазного провода, вторым — к предполагаемой нейтрали (синего цвета). Если при этом стрелка на приборе отклоняется (запоминаем ее положение) или на индикаторе загорается цифра, близкая к 220 В. Проделываем ту же операцию со вторым проводником — который по цвету определили как «землю». Если все верно, показания прибора должны быть ниже — меньше чем те, которые были перед этим.
Тестер дает однозначный ответ
В случае, если цветовая маркировка проводов отсутствует, придется перебирать все пары, определяя назначение проводников по показаниям. Пользуемся тем же правилом: при прозвонке пары «фаза-земля» показания ниже, чем при прозвонке пары «фаза-ноль».
Маркировка кабеля СИП-4 по цветам
В этой статье вы узнаете, как маркируется по цветам двухпроводный кабель СИП-4, то есть каким цветом у него обозначается «фаза» и как обозначается нулевой провод или попросту «ноль».
Начнем с необходимых определений (выдержка из ГОСТ 31946-2012 ):
СИП (самонесущий изолированный провод): многожильный провод для воздушных линий электропередачи, содержащий изолированные жилы и несущий элемент, предназначенный для крепления или подвески провода.
Нулевая несущая жила: изолированная или неизолированная токопроводящая жила из алюминиевого сплава, выполняющая функцию несущего элемента и нулевого рабочего (N) или нулевого защитного (РЕ) проводника.
Основная жила: изолированная токопроводящая жила, предназначенная для выполнения основной функции провода.
Изоляция (рабочая изоляция): электрическая изоляция токопроводящих жил самонесущего изолированного провода для воздушных линий электропередачи на напряжение до 0,6/1 кВ, обеспечивающая нормальную работу воздушных линий электропередачи и защиту от поражения электрическим током.
Маркировка СИП (выдержка из ГОСТ 31946-2012)
5.2.7.2 Основные токопроводящие жилы самонесущих изолированных проводов должны иметь отличительное обозначение в виде продольно выпрессованных рельефных полос на изоляции, как показано на рисунке Б.1 (приложение Б), или цифр 1, 2, 3, нанесенных тиснением или печатным способом. Изолированная нулевая несущая жила не должна иметь отличительного обозначения. Отличительное обозначение также может быть выполнено в виде цветных продольных полос шириной не менее 1 мм. Цвет полос должен быть контрастным по отношению к черному цвету. Вспомогательные жилы для цепей освещения должны иметь отличительное обозначение: «В1», «В2» или «В3», нанесенное тиснением или печатным способом. Маркировка цифрами и буквами тиснением или печатным способом должна производиться с интервалом не более 500 мм. Высота цифр (букв) должна быть не менее 5 мм, ширина — не менее 2 мм (для цифры 1 минимальная ширина — 1 мм). Вспомогательные жилы для цепей контроля могут не иметь отличительного обозначения. Отличительное обозначение, выполненное печатным способом или в виде цветных продольных полос, должно быть стойким к воздействию солнечного излучения в течение всего срока службы.
Рисунок Б.1 1(первая жила) — одна полоса; 2 (вторая жила) — две полосы; 3 (третья жила) — три полосы; (нулевая жила) — без обозначения. Размеры a,b,h являются справочными.
Из вышесказанного следует: если например на китайском или российском кабеле СИП-4 2х16 мм одна из жил имеет цветную полоску — значит это «фаза». Жила не имеющая отличительных изображений соответственно «ноль».
Добавить комментарий
Цветовая маркировка проводов
В советское время не использовалась цветовая маркировка проводов: все они были либо белыми, либо иногда чёрными. Для того чтобы отыскать нужную жилу в такой проводке, приходится ставить их все под напряжение и проверять каждую в отдельности. Из-за усиления мер электробезопасности теперь применяется обозначение силовых проводов определёнными цветами. Правила цветовой маркировки закреплены в ПУЭ седьмого издания. Использование данного метода обозначения силовых линий позволяет повысить электробезопасность и сэкономить время при выполнении любых работ на электрооборудовании.
Для разных сетей используются свои цвета. В трёхфазных сетях на шинах трансформаторных подстанций применяется следующее обозначение:
— фаза А — жёлтый цвет;
— фаза В — зелёный;
— Фаза С — красный;
— нулевая рабочая фаза N — синий;
— защитная линия «земля» PE — двухцветная жёлто-зелёная изоляция.
Если шина заземления прокладывается открытым способом, то допускается окрашивание её в чёрный цвет, что позволяет повысить защищённость против коррозии.
В обычных кабелях используется обозначение для фаз А, В, С: белый, чёрный, красный соответственно, рабочая нейтраль — синий, заземление PE — жёлто-зелёный. Если нулевой провод и земля совмещены, то используется жёлто-зелёный провод, при этом на концы линии обязательно должны быть нанесены голубые метки.
Для однофазных сетей ПУЭ предусматривает такое обозначение:
— рабочая нулевая нейтраль N — голубой цвет;
— заземление PE — двухцветный жёлто-зелёный цвет;
— фаза — чаще всего применяется коричневый или чёрный цвет, однако правила ПУЭ допускают использование других цветов: красного, оранжевого, розово-белого, серого, фиолетового, бирюзового.
В случае совмещения нейтрали N и заземления PE применяется аналогично трёхфазным линиям желто-зелёная изоляция с нанесением голубых меток на оба конца линии.
В практике электрика постоянно попадается «нестандартная» маркировка. Для того чтобы обозначить неформатные провода, рекомендуется использовать дополнительную маркировку, которая закрепляется на концах жил (бирки). Для этого можно пользоваться несмываемыми маркерами, ПВХ изолентой, маркировочными бирками как ручного, так и заводского изготовления или другими аналогичными приспособлениями. Цвета маркеров должны соответствовать закреплённой в ПУЭ цветовой маркировке.
Inventiva получает от Управления по контролю за продуктами и лекарствами США статус прорывной терапии для ланифибранора-кандидата в ведущие лекарственные препараты на Парижской фондовой бирже NASH: IVA
- Назначение на основании положительных результатов клинического исследования фазы IIb NATIVE по оценке ланифибранора при неалкогольном стеатогепатите (НАСГ)
- Ланифибранор считается первым препаратом-кандидатом, получившим статус прорывной терапии при НАСГ с 2015 г.
- В настоящее время Нет одобренных FDA методов лечения этого распространенного и прогрессирующего хронического заболевания печени
- Это обозначение дополнительно подтверждает решение о начале основного клинического исследования фазы III с ланифибранором в течение полугодия 2021 г.
Daix (Франция), 12 октября, 2020 — Inventiva (Euronext Paris и Nasdaq: IVA), биофармацевтическая компания клинической стадии, специализирующаяся на разработке пероральных низкомолекулярных препаратов для лечения неалкогольного стеатогепатита (НАСГ), мукополисахаридозов (МПС) и других заболеваний со значительными неудовлетворенными проблемами. медицинская необходимость, сегодня объявили, что У.Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) присвоило ланифибранору, ведущему кандидату компании в лекарствах для лечения НАСГ, статус прорывной терапии. Ланифибранор считается первым лекарством-кандидатом, которому был предоставлен этот статус для лечения НАСГ с января 2015 года.
Назначение «прорывной терапии» FDA предназначено для ускорения разработки и рассмотрения кандидатов на лекарственные препараты для лечения серьезных или опасных для жизни состояний. . Чтобы претендовать на это назначение, кандидаты в препараты должны предоставить предварительные клинические доказательства того, что они могут продемонстрировать существенное улучшение по крайней мере одного клинически значимого конечного результата по сравнению с доступными методами лечения или по сравнению с плацебо, если нет одобренных методов лечения.
Признание ланифибранора передовой терапией для лечения НАСГ последовало за публикацией в июне 2020 года положительных результатов клинического исследования фазы IIb НАТИВНОЙ фазы IIb исследования Inventiva с ланифибранором у пациентов с НАСГ. В этом 24-недельном клиническом испытании ланифибранор достиг основной конечной точки со статистически значимым снижением показателя стеатозной активности фиброза (SAF), который сочетает в себе оценки гепатоцеллюлярного воспаления и раздува с отсутствием ухудшения фиброза в намерении лечить (ITT 1). ) и популяций согласно протоколу (PP 2 ).Кроме того, ланифибранор соответствовал ключевым вторичным конечным точкам, включая разрешение НАСГ без ухудшения фиброза 3 и улучшение фиброза печени без ухудшения НАСГ 4 как в популяциях ITT, так и в PP. Что касается вторичных конечных точек, ланифибранор является первым лекарством-кандидатом, достигшим статистически значимых результатов по основным конечным точкам FDA и Европейского медицинского агентства (EMA), которые имеют отношение к ускоренному одобрению во время клинической разработки фазы III.
Inventiva, как ожидается, проведет завершающее совещание НАТИВНОЙ фазы IIb клинического исследования с FDA и получит обратную связь от EMA в течение четвертого квартала 2020 года с началом клинического исследования фазы III по оценке ланифибранора при НАСГ, запланированном на первое половина 2021 года.
Фредерик Крен, председатель, главный исполнительный директор и соучредитель Inventiva, прокомментировал : « В преддверии завершения встречи Фазы IIb с FDA в конце этого года, Ланифибранор получил обозначение прорывной терапии. фантастические достижения и официальное признание значительных клинических преимуществ, которые ланифибранор может предоставить пациентам с НАСГ, как показано в нашем недавнем клиническом исследовании Фазы IIb NATIVE.Этот новый статус позволит нам продолжить разработку ланифибранора в направлении безопасного и эффективного лечения этого разрушительного заболевания, и мы надеемся продолжить тесное сотрудничество с FDA с этой целью ».
Об обозначении прорывной терапии 5
Обозначение прорывной терапии — это процесс, предназначенный для ускорения разработки и пересмотра лекарств в Соединенных Штатах, которые предназначены для лечения серьезного состояния, и предварительные клинические данные указывают на то, что лекарство может продемонстрировать существенное улучшение по сравнению с доступной терапией в клинически значимой конечной точке ( с).
Лекарство, получившее обозначение Breakthrough Therapy, соответствует следующим критериям:
- Все признаки обозначения Fast Track;
- Интенсивное руководство по эффективной программе разработки лекарств, начиная с фазы 1;
- Организационные обязательства с участием руководителей высшего звена.
О ланифибраноре
Ланифибранор, ведущий продукт-кандидат Inventiva, представляет собой перорально доступную небольшую молекулу, которая вызывает антифиброзные, противовоспалительные и полезные сосудистые и метаболические изменения в организме путем активации всех трех пролифераторов пероксисом. Изоформы активированных рецепторов (PPAR), которые представляют собой хорошо охарактеризованные ядерные рецепторные белки, регулирующие экспрессию генов.Ланифибранор является агонистом PPAR, который предназначен для умеренно активного воздействия на все три изоформы PPAR, с хорошо сбалансированной активацией PPARα и PPARδ и частичной активацией PPARγ. В то время как существуют другие агонисты PPAR, которые нацелены только на одну или две изоформы PPAR для активации, ланифибранор является единственным агонистом пан-PPAR, находящимся в клинической разработке. Inventiva считает, что умеренный и сбалансированный профиль связывания пан-PPAR ланифибранора способствует благоприятному профилю переносимости, который наблюдался в клинических испытаниях и доклинических исследованиях на сегодняшний день.
Об исследовании NATIVE фазы IIb
Клиническое исследование NATIVE (испытание NAsh для подтверждения эффективности IVA337) представляло собой 24-недельное рандомизированное двойное слепое плацебо-контролируемое клиническое исследование фазы IIb по оценке ланифибранора для лечения пациентов с НАШ. Основная цель исследования заключалась в оценке эффективности ланифибранора в уменьшении воспаления печени и баллонирования — двух гистологических маркеров, включенных в определение регуляторной конечной точки разрешения НАСГ.Для включения в исследование пациенты должны были иметь: диагноз НАСГ, подтвержденный биопсией печени; совокупный балл воспаления и вздутия (при измерении с использованием системы подсчета баллов SAF) от трех до четырех из четырех, что указывает на наличие воспаления от умеренного до тяжелого и вздутие живота; оценка стеатоза больше или равна единице, что указывает на наличие стеатоза от умеренного до тяжелого; и оценка фиброза менее четырех, что указывает на отсутствие цирроза печени. Первичной конечной точкой исследования было снижение комбинированной оценки воспаления и раздува на два балла по сравнению с исходным уровнем без ухудшения фиброза, как измерено по шкале SAF.Вторичные конечные точки включали разрешение НАСГ, улучшение каждого из показателей стеатоза, воспаления, раздува и фиброза по сравнению с исходным уровнем, измеряемым с помощью шкалы SAF, улучшения различных других показателей фиброза, улучшения нескольких метаболических маркеров, улучшения стеатоза, воспаления и вздутие живота, как измерено. с использованием оценки NAS (оценка активности НАЖБП) и безопасности.
В ходе исследования было рандомизировано 247 пациентов с НАСГ в 71 учреждении в Австралии, Канаде, Европе, Маврикии и США.
О компании Inventiva
Inventiva — это биофармацевтическая компания клинической стадии, специализирующаяся на разработке оральных низкомолекулярных препаратов для лечения НАСГ, МПС и других заболеваний, требующих значительных неудовлетворенных медицинских потребностей.
Используя свои знания и опыт в области соединений, нацеленных на ядерные рецепторы, факторы транскрипции и эпигенетическую модуляцию, Inventiva в настоящее время продвигает двух клинических кандидатов, а также глубокую линейку программ более ранних стадий.
Ланифибранор, его главный кандидат в продукте, разрабатывается для лечения пациентов с НАСГ, распространенным и прогрессирующим хроническим заболеванием печени, для которого в настоящее время нет одобренных методов лечения. Inventiva недавно объявила о положительных данных по линии верха из своего клинического исследования фазы IIb, посвященного оценке ланифибранора для лечения пациентов с НАСГ.
Inventiva также разрабатывает одипарцил, актив второй клинической стадии, для лечения пациентов с подтипами МПС, группой редких генетических нарушений.Клинические испытания фазы I / II у детей с MPS VI в настоящее время находятся в стадии подготовки после публикации положительных результатов клинических испытаний фазы IIa у взрослых пациентов с MPS VI в конце 2019 года.
Параллельно Inventiva находится в процессе выбор кандидата на развитие онкологии для своей программы сигнального пути Hippo. Кроме того, Компания установила стратегическое сотрудничество с AbbVie в области аутоиммунных заболеваний. AbbVie приступила к клинической разработке ABBV ‑ 157, лекарственного препарата-кандидата для лечения псориаза средней и тяжелой степени тяжести, возникшего в результате сотрудничества с Inventiva.Это сотрудничество позволяет Inventiva получать промежуточные платежи по достижении доклинических, клинических, нормативных и коммерческих этапов в дополнение к гонорарам за любые одобренные продукты, полученные в результате сотрудничества.
В компании работает научная команда из примерно 70 человек, обладающих глубокими знаниями в области биологии, медицинской и вычислительной химии, фармакокинетики и фармакологии, а также клинических разработок. Он также владеет обширной библиотекой из примерно 240 000 фармакологически релевантных молекул, примерно 60% из которых являются собственностью, а также полностью находящимся в собственности научно-исследовательским центром.
Inventiva — публичная компания, котирующаяся в секторе C регулируемого рынка Euronext Paris (тикер: IVA — ISIN: FR0013233012) и на глобальном рынке Nasdaq в США (тикер: IVA). www.inventivapharma.com
Контакты
Inventiva
Фредерик Крен
Председатель и главный исполнительный директор
[email protected]
+33 3 80 44 75 00
Brunickswick Group Тецлафф / Тристан Роке Монтегон /
Aude Lepreux
Связи со СМИ
inventiva @ brunswickgroup.com
+33 1 53 96 83 83
Westwicke, ICR Company
Patricia L. Bank
Связи с инвесторами
[email protected]
+1 415 513 1284
Важно Уведомление
Этот пресс-релиз содержит прогнозные заявления, прогнозы и оценки в отношении клинических испытаний Inventiva, опубликованных данных клинических испытаний, планов клинических разработок и предполагаемой будущей деятельности Inventiva.Некоторые из этих заявлений, прогнозов и оценок можно распознать по таким словам, как, без ограничения, «полагает», «ожидает», «ожидает», «намеревается», «планирует», «ищет», «оценивает», «Может», «будет» и «продолжать» и подобные выражения. Такие заявления не являются историческими фактами, а скорее являются заявлениями о будущих ожиданиях и другими прогнозными заявлениями, основанными на убеждениях руководства. Эти заявления отражают такие взгляды и предположения, преобладающие на дату таких заявлений, и включают известные и неизвестные риски и неопределенности, которые могут привести к тому, что будущие результаты, показатели или будущие события будут существенно отличаться от тех, которые выражены или подразумеваются в таких заявлениях.Фактические события трудно предсказать, и они могут зависеть от факторов, неподконтрольных Inventiva. В отношении кандидатов на готовый продукт не может быть никаких гарантий, что результаты клинических испытаний будут доступны в ожидаемые сроки, что будущие клинические испытания будут инициированы, как ожидалось, или что кандидаты получат необходимые разрешения регулирующих органов. Фактические результаты могут существенно отличаться от ожидаемых будущих результатов, показателей или достижений, выраженных или подразумеваемых в таких заявлениях, прогнозах и оценках, из-за ряда факторов, включая то, что Inventiva понесла значительные убытки с момента создания, Inventiva имеет ограниченные история деятельности и никогда не приносила дохода от продаж продукции, Inventiva потребуется дополнительный капитал для финансирования своей деятельности, будущий успех Inventiva зависит от успешной клинической разработки, утверждения регулирующими органами и последующей коммерциализации текущих и любых будущих продуктов-кандидатов, доклинических исследований или более ранних клинические испытания не обязательно позволяют прогнозировать будущие результаты, и результаты клинических испытаний Inventiva могут не подтверждать заявления о продукте Inventiva-кандидата, Inventiva может столкнуться со значительными задержками в своих клинических испытаниях или Inventiva может не продемонстрировать безопасность и эффективность в соответствии с требованиями применимых нормативных требований. общественность, набор и удержание пациентов в клинических испытаниях — это дорогостоящий и трудоемкий процесс, который может быть затруднен или невозможен из-за множества факторов, не зависящих от Inventiva, продукты-кандидаты Inventiva могут вызывать нежелательные побочные эффекты или обладать другими свойствами, которые могут задерживать или препятствовать их разрешению регулирующими органами или ограничивать их коммерческий потенциал, Inventiva сталкивается со значительной конкуренцией, и текущая пандемия COVID-19 может существенно и неблагоприятно повлиять на бизнес Inventiva, доклинические исследования, программы и сроки клинических разработок, ее финансовое состояние и результаты деятельности.Учитывая эти риски и неопределенности, мы не делаем никаких заявлений относительно точности или справедливости таких прогнозных заявлений, прогнозов и оценок. Кроме того, прогнозные заявления, прогнозы и оценки действительны только на дату этого пресс-релиза. Вниманию читателей: не следует чрезмерно полагаться на какие-либо из этих прогнозных заявлений.
См. Универсальный регистрационный документ, поданный в Autorité des Marchés Financiers 19 июня 2020 г. под номером D.20-0551 и поправка к нему, поданная 10 июля 2020 года под № D. 20-0551-A01, а также полугодовой финансовый отчет 30 июня 2020 года для получения дополнительной информации в отношении таких факторов, рисков и неопределенностей.
За исключением случаев, предусмотренных законом, Inventiva не имеет намерения и не обязана обновлять или пересматривать прогнозные заявления, упомянутые выше. Следовательно, Inventiva не несет ответственности за любые последствия, возникающие в результате использования любого из приведенных выше утверждений.
1 ITT: включает всех пациентов, рандомизированных в исследование.
2 PP: включает всех пациентов с парными биопсиями и без отклонений, влияющих на оценку эффективности.
3 Разрешение НАСГ и отсутствие обострения фиброза определяется как оценка лобулярного воспаления CRN, равная 0 или 1, и балльная оценка раздувания гепатоцитов CRN, равная 0, без ухудшения оценки CRN-фиброза.
4 Улучшение фиброза печени без ухудшения НАСГ , определяемое как улучшение оценки CRN-фиброза ≥ 1 стадии и отсутствие увеличения оценки CRN-стеатоза, а также отсутствие увеличения оценки CRN-воспаление и отсутствие увеличения CRN-раздувания счет.
5 https://www.fda.gov/patients/fast-track-breakthrough-therapy-accelerated-approval-priority-review/breakthrough-therapy .
- Inventiva — PR — Ланифибранор — Обозначение прорывной терапии — EN — 12 10 20
| Заявления о перспективах Санофи
Заявления о перспективах Regeneron и использование цифровых носителей Этот пресс-релиз включает заявления о перспективах, которые связаны с рисками и неопределенностями, связанными с будущими событиями и будущими показателями Regeneron Pharmaceuticals, Inc. . («Regeneron» или «Компания»), и фактические события или результаты могут существенно отличаться от этих прогнозных заявлений.Такие слова, как «ожидать», «ожидать», «намереваться», «планировать», «полагать», «искать», «оценивать», варианты таких слов и аналогичные выражения предназначены для обозначения таких прогнозных заявлений, хотя не все прогнозные заявления содержат эти идентифицирующие слова. Эти заявления касаются, и эти риски и неопределенности включают, среди прочего, влияние SARS-CoV-2 (вируса, вызвавшего пандемию COVID-19) на бизнес Regeneron и его сотрудников, сотрудников, поставщиков и других третьих сторон на на которую полагается Regeneron, способность Regeneron и его сотрудников продолжать проводить исследования и клинические программы, способность Regeneron управлять своей цепочкой поставок, чистые продажи продуктов, продаваемых Regeneron и / или его сотрудниками (совместно именуемые «Продукты Regeneron»), и мировая экономика; характер, время и возможный успех и терапевтическое применение продуктов Regeneron и продуктов-кандидатов Regeneron, а также проводимых или планируемых исследований и клинических программ, включая, помимо прочего, Dupixent® (дупилумаб) для лечения пациентов 12 лет и старше с эозинофильным эзофагитом; вероятность, сроки и объем возможного одобрения регулирующими органами и коммерческого запуска продуктов-кандидатов Regeneron и новых показаний для продуктов Regeneron, таких как дупилумаб для лечения эозинофильного эзофагита, детской астмы, педиатрического атопического дерматита, хронической обструктивной болезни легких, буллезного пемфигоида, узловатая почесуха, хроническая спонтанная крапивница, пищевая и экологическая аллергия и другие возможные показания; влияние (если таковое имеется) статуса прорывной терапии, предоставленного Dupixent для лечения пациентов от 12 лет и старше с эозинофильным эзофагитом U.S. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов («FDA») о том, получит ли Dupixent одобрение FDA в этом показании, и о сроках такого потенциального одобрения; неопределенность рыночного признания и коммерческого успеха продуктов Regeneron и продуктов-кандидатов, а также влияние исследований (проводимых Regeneron или другими, обязательных или добровольных) на коммерческий успех продуктов Regeneron (таких как Dupixent) и продуктов-кандидатов; проблемы безопасности, возникающие в результате применения продуктов Regeneron (таких как Dupixent) и продуктов-кандидатов у пациентов, включая серьезные осложнения или побочные эффекты в связи с использованием продуктов Regeneron и продуктов-кандидатов в клинических испытаниях; определения регулирующих и административных государственных органов, которые могут задерживать или ограничивать способность Regeneron продолжать разработку или коммерциализацию продуктов Regeneron и продуктов-кандидатов; текущие нормативные обязательства и надзор за продуктами, исследованиями и клиническими программами Regeneron, а также бизнесом, включая те, которые касаются конфиденциальности пациентов; доступность и объем возмещения продуктов Regeneron от сторонних плательщиков, включая программы медицинского и страхового обслуживания частных плательщиков, организации по поддержанию здоровья, компании по управлению льготами в аптеке и государственные программы, такие как Medicare и Medicaid; определения покрытия и возмещения такими плательщиками, а также новые политики и процедуры, принятые такими плательщиками; конкурирующие препараты и продукты-кандидаты, которые могут превосходить или быть более рентабельными, чем продукты и продукты-кандидаты Regeneron; степень, в которой результаты программ исследований и разработок, проводимых Regeneron и / или его сотрудниками, могут быть воспроизведены в других исследованиях и / или привести к продвижению продуктов-кандидатов для клинических испытаний, терапевтических приложений или утверждения регулирующими органами; способность Regeneron производить и управлять цепочками поставок для множества продуктов и продуктов-кандидатов; способность сотрудников Regeneron, поставщиков или других третьих лиц (в зависимости от обстоятельств) выполнять производство, наполнение, отделку, упаковку, маркировку, распространение и другие шаги, связанные с Продуктами Regeneron и продуктами-кандидатами; непредвиденные расходы; затраты на разработку, производство и продажу продукции; способность Regeneron выполнять любые свои финансовые прогнозы или указания и вносить изменения в предположения, лежащие в основе этих прогнозов или указаний; возможность заключения любой лицензии или соглашения о сотрудничестве, включая соглашения Regeneron с Sanofi, Bayer и Teva Pharmaceutical Industries Ltd.(или их соответствующих аффилированных компаний, если применимо), которые должны быть отменены или прекращены без дальнейшего успеха продукта; и риски, связанные с интеллектуальной собственностью других сторон, а также с рассматриваемыми или будущими судебными разбирательствами, связанными с этим (включая, помимо прочего, патентные разбирательства и другие связанные судебные разбирательства, касающиеся EYLEA ® (афлиберцепт) Injection, Dupixent и Praluent ® (алирокумаб)), другие судебные и другие судебные разбирательства и правительственные расследования, касающиеся Компании и / или ее операций, конечный результат любых таких судебных разбирательств и расследований, а также влияние любого из вышеперечисленного на бизнес, перспективы, операционные результаты и финансовое состояние Regeneron.Более полное описание этих и других существенных рисков можно найти в документации Regeneron в Комиссию по ценным бумагам и биржам США, включая форму 10-K за год, закончившийся 31 декабря 2019 г., и форму 10-Q за квартальный период, закончившийся в июне. 30, 2020. Любые прогнозные заявления основаны на текущих убеждениях и суждениях руководства, и читателю рекомендуется не полагаться на какие-либо прогнозные заявления, сделанные Regeneron. Regeneron не берет на себя никаких обязательств по публичному обновлению каких-либо прогнозных заявлений, включая, помимо прочего, любые финансовые прогнозы или рекомендации, будь то в результате новой информации, будущих событий или иным образом.
Regeneron использует свои средства массовой информации и веб-сайт по связям с инвесторами и социальные сети для публикации важной информации о Компании, включая информацию, которая может быть сочтена существенной для инвесторов. Финансовая и другая информация о Regeneron регулярно публикуется и доступна на веб-сайте Regeneron для СМИ и по связям с инвесторами (http://newsroom.regeneron.com) и в его ленте Twitter (http://twitter.com/regeneron). |
CRISPR Therapeutics и Vertex объявляют FDA о назначении ускоренного режима для CTX001 для лечения бета-талассемии
ZUG, Швейцария и КЕМБРИДЖ, Массачусетс.и БОСТОН, 16 апреля 2019 г. (GLOBE NEWSWIRE) — CRISPR Therapeutics (Nasdaq: CRSP) и Vertex Pharmaceuticals Incorporated (Nasdaq: VRTX) сегодня объявили, что Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) предоставило ускоренное обозначение CTX001 для лечение трансфузионно-зависимой бета-талассемии (TDT). CTX001 — это исследовательская, аутологичная, генно-редактируемая терапия гемопоэтическими стволовыми клетками для пациентов, страдающих тяжелыми гемоглобинопатиями.
Программа Fast Track FDA предназначена для облегчения разработки и ускорения обзора лекарств, которые лечат серьезные состояния и удовлетворяют неудовлетворенные медицинские потребности.Лекарство, получившее Fast Track Designation, может иметь право на получение нескольких льгот, включая более частые встречи и общение с FDA и, при соблюдении соответствующих критериев, возможность ускоренного утверждения, приоритетного рассмотрения или последовательного рассмотрения заявки на лицензию на биологические препараты (BLA).
В феврале 2019 года CRISPR Therapeutics и Vertex объявили, что первый пациент прошел курс лечения CTX001 в рамках фазы 1/2 клинического исследования пациентов с TDT, что стало первым клиническим испытанием, спонсируемым компанией, с использованием терапии CRISPR / Cas9.Открытое исследование фазы 1/2 предназначено для оценки безопасности и эффективности однократной дозы CTX001 у пациентов в возрасте от 18 до 35 лет с TDT, подтипами, отличными от бета-нуля / бета-нуля. Компании также оценивают CTX001 для лечения серповидно-клеточной анемии (SCD) и в январе 2019 года получили обозначение Fast Track для CTX001 от FDA для SCD. В феврале 2019 года компании объявили, что первый пациент был включен в клиническое исследование фазы 1/2 CTX001 при тяжелой ВСС в США и, как ожидается, в середине 2019 года будет введен CTX001.Набор в оба исследования продолжается.
О CTX001
CTX001 — это экспериментальная ex vivo CRISPR-ген-отредактированная терапия, которая оценивается для пациентов, страдающих TDT или тяжелой SCD, при которой гемопоэтические стволовые клетки пациента сконструированы для производства высоких уровней гемоглобина плода (HbF; гемоглобин F) в красных кровяных тельцах. HbF — это форма гемоглобина, переносящего кислород, который естественным образом присутствует при рождении и затем замещается взрослой формой гемоглобина.Повышение HbF с помощью CTX001 может облегчить потребность в переливании крови для пациентов с TDT и болезненные и изнурительные серповидные кризы у пациентов с SCD.
CTX001 разрабатывается в рамках соглашения о совместной разработке и совместной коммерциализации между CRISPR Therapeutics и Vertex.
О сотрудничестве CRISPR-Vertex
CRISPR Therapeutics и Vertex в 2015 году заключили соглашение о стратегическом исследовательском сотрудничестве, направленном на использование CRISPR / Cas9 для обнаружения и разработки потенциальных новых методов лечения, направленных на устранение основных генетических причин заболеваний человека.CTX001 представляет собой первый препарат, появившийся в результате совместной исследовательской программы. CRISPR Therapeutics и Vertex будут совместно разрабатывать и коммерциализировать CTX001 и в равных долях разделять все затраты и прибыль на исследования и разработки по всему миру.
О CRISPR Therapeutics
CRISPR Therapeutics — ведущая компания по редактированию генов, специализирующаяся на разработке трансформирующих генных лекарств от серьезных заболеваний с использованием собственной платформы CRISPR / Cas9. CRISPR / Cas9 — это революционная технология редактирования генов, позволяющая точно и направленно изменять геномную ДНК.CRISPR Therapeutics создала портфель терапевтических программ по широкому кругу областей заболеваний, включая гемоглобинопатии, онкологию, регенеративную медицину и редкие заболевания. Чтобы ускорить и расширить свои усилия, CRISPR Therapeutics наладила стратегическое сотрудничество с ведущими компаниями, включая Bayer AG, Vertex Pharmaceuticals и ViaCyte, Inc. Штаб-квартира CRISPR Therapeutics AG находится в Цуге, Швейцария, со своим 100-процентным дочерним предприятием в США, CRISPR Therapeutics, Inc. , а также научно-исследовательские и опытно-конструкторские работы в Кембридже, штат Массачусетс, и офисы в Лондоне, Великобритания.Для получения дополнительной информации посетите www.crisprtx.com.
Заявление о перспективах CRISPR
Этот пресс-релиз может содержать ряд «прогнозных заявлений» по смыслу Закона о реформе судебных разбирательств по частным ценным бумагам 1995 г. с внесенными в него поправками, включая заявления относительно ожиданий CRISPR Therapeutics в отношении любых или все нижеперечисленное: (i) клинические испытания (включая, помимо прочего, сроки подачи заявок на клинические испытания и IND, любые их утверждения и сроки начала клинических испытаний), сроки разработки и обсуждения с регулирующими органами, связанные с продуктом кандидаты, разрабатываемые CRISPR Therapeutics и ее сотрудниками; (ii) количество пациентов, которые будут оцениваться, предполагаемая дата, к которой будет завершен набор, и данные, которые будут получены в ходе текущих и запланированных клинических испытаний, а также возможность использовать эти данные для разработки и начала дальнейших клинических исследований. судебные процессы; (iii) объем и сроки текущих и потенциальных будущих клинических испытаний; (iv) охват интеллектуальной собственности и позиции CRISPR Therapeutics, ее лицензиаров и третьих сторон; (v) достаточность денежных средств CRISPR Therapeutics; и (vi) терапевтическая ценность, развитие и коммерческий потенциал технологий редактирования генов CRISPR / Cas9 и методов лечения.Не ограничивая вышесказанное, слова «полагает», «ожидает», «планирует», «ожидает» и аналогичные выражения предназначены для обозначения прогнозных заявлений. Вас предупреждают, что прогнозные заявления по своей сути неопределенны. Хотя CRISPR Therapeutics считает, что такие заявления основаны на разумных предположениях в пределах своих знаний о своем бизнесе и операциях, прогнозные заявления не являются ни обещаниями, ни гарантиями, и они обязательно связаны с высокой степенью неопределенности и риска.Фактические показатели и результаты могут существенно отличаться от прогнозируемых или предполагаемых в прогнозных заявлениях из-за различных рисков и неопределенностей. Эти риски и неопределенности включают, среди прочего: результаты запланированных клинических испытаний и исследований CRISPR Therapeutics могут быть неблагоприятными; что одна или несколько программ-кандидатов на внутренние или внешние продукты CRISPR Therapeutics не будут реализовываться в соответствии с планом по техническим, научным или коммерческим причинам; что будущие конкурентные или другие рыночные факторы могут отрицательно повлиять на коммерческий потенциал продуктов-кандидатов CRISPR Therapeutics; неопределенности, связанные с началом и завершением доклинических исследований продуктов-кандидатов CRISPR Therapeutics; наличие и сроки получения результатов доклинических исследований; будут ли результаты доклинических испытаний предсказывать будущие результаты будущих испытаний; неопределенность в отношении разрешений регулирующих органов на проведение испытаний или выпуск продукции на рынок; неопределенности в отношении защиты интеллектуальной собственности на технологию CRISPR Therapeutics и интеллектуальной собственности, принадлежащей третьим сторонам; и те риски и неопределенности, которые описаны под заголовком «Факторы риска» в последнем годовом отчете CRISPR Therapeutics по форме 10-K, а также в любых других последующих документах, поданных CRISPR Therapeutics в U.S. Комиссии по ценным бумагам и биржам, которые доступны на веб-сайте SEC по номеру www.sec.gov . Существующим и потенциальным инвесторам рекомендуется не полагаться чрезмерно на эти прогнозные заявления, которые действительны только на дату, когда они сделаны. CRISPR Therapeutics отказывается от каких-либо обязательств или обязательств по обновлению или пересмотру любых прогнозных заявлений, содержащихся в этом пресс-релизе, за исключением случаев, предусмотренных законом.
О Vertex
Vertex — это глобальная биотехнологическая компания, которая инвестирует в научные инновации с целью создания преобразующих лекарств для людей с серьезными и опасными для жизни заболеваниями.Помимо программ клинических исследований муковисцидоза, Vertex имеет более десятка текущих исследовательских программ, направленных на изучение механизмов, лежащих в основе других серьезных заболеваний.
Основанная в 1989 году в Кембридже, штат Массачусетс, штаб-квартира Vertex сейчас находится в инновационном районе Бостона. Сегодня у компании есть научно-исследовательские центры и коммерческие офисы в США, Европе, Канаде, Австралии и Латинской Америке. Vertex неизменно признается одним из лучших мест для работы в отрасли, в том числе девять лет подряд входит в список лучших работодателей журнала Science в рейтинге наук о жизни.
Для получения дополнительной информации и последних обновлений от компании посетите сайт www.vrtx.com.
(VRTX-GEN)
Vertex Специальное примечание относительно прогнозных заявлений
Этот пресс-релиз содержит прогнозные заявления, как это определено в Законе о реформе судебных разбирательств по частным ценным бумагам 1995 года, включая, помимо прочего, заявления о потенциальных преимуществах ускоренного доступа и текущих клинических испытаний. испытания CTX001. Хотя Vertex считает, что прогнозные заявления, содержащиеся в этом пресс-релизе, точны, существует ряд факторов, которые могут привести к тому, что фактические события или результаты будут существенно отличаться от тех, которые указаны в таких прогнозных заявлениях.Эти риски и неопределенности включают, среди прочего, риски, связанные с разработкой кандидатов в лекарственные препараты, и другие риски, перечисленные в разделе «Факторы риска» в годовом отчете Vertex и ежеквартальных отчетах, поданных в Комиссию по ценным бумагам и биржам. Vertex отказывается от каких-либо обязательств по обновлению информации, содержащейся в этом пресс-релизе, по мере появления новой информации.
CRISPR Контакт с инвестором: Сьюзан Ким
+1 617-307-7503
[email protected]
CRISPR Контактное лицо для СМИ: Дженнифер Паганелли
WCG от имени CRISPR
+1 347-658-8290
jpaganelli @ wcgworld.com
Vertex Pharmaceuticals Incorporated
Инвесторы: Майкл Партридж, +1 617-341-6108
или Эрик Рохас, +1 617-961-7205
или Зак Барбер, +1 617-341-6470
СМИ: [email protected]
или
Северная Америка: Хизер Николс, +1 617-341-6992
[email protected]
Источник: CRISPR Therapeutics AG
.
Фаза 3 FDA — Акорафлоксацин (аварофлоксацин) получил статус QIDP и Fast Track «Разрешение на новые лекарственные препараты
25 февраля 2013 г.
Аварофлоксацин получил статус QIDP и Fast Track.
JNJ-Q2, JNJ-32729463-AAA
CAS NO 878592-87-1 базы
7- [3- [2-амино-1 (E) -фторэтилиден] пиперидин-1-ил] -1-циклопропил-6-фтор-8-метокси-4-оксо-1,4-дигидрохинолин-3-карбоновая кислота кислота
Furiex Pharmaceuticals Inc.объявил, что FDA предоставило квалифицированный препарат для лечения инфекционных заболеваний (QIDP) и обозначение ускоренного режима для аварофлоксацина (JNJ-Q2). Аварофлоксацин — это готовый к Фазе 3 фторхинолоновый антибиотик широкого спектра действия для лечения острых бактериальных инфекций кожи и кожных структур (ABSSSI), внебольничной пневмонии и доказал свою эффективность при лечении метициллин-резистентных Staphylococcus aureus (MRSA) инфекции.
Аварофлоксацин — это новый исследуемый фторхинолоновый антибиотик, эффективность которого была подтверждена в исследовании Фазы 2 инфекций ABSSSI.В этом исследовании аварофлоксацин продемонстрировал благоприятную эффективность как для конечных точек раннего клинического ответа, так и для всех конечных точек клинического излечения для намерения лечить популяцию.
Аварофлоксацин имеет низкую тенденцию к развитию лекарственной устойчивости и проявляет широкий спектр антибактериальной активности in vitro , включая MRSA, устойчивый к фторхинолонам Staphylococcus aureus , Streptococcus pneumoniae (включая штаммы с множественной лекарственной устойчивостью), грамположительные , грамотрицательные, атипичные респираторные патогены (такие как legionella и mycoplasma ) и анаэробные бактерии, которые часто связаны с абсцессами кожи и других органов.
Доступность аварофлоксацина для внутривенного и перорального введения отличает его от ряда других препаратов для лечения инфекций MRSA, которые доступны только для внутривенного введения.
Для получения дополнительной информации звоните (919) 456-7800 или посетите http://www.furiex.com/
О метициллин-устойчивом золотистом стафилококке (MRSA)
MRSA — это штамм бактерий золотистого стафилококка (стафилококка), который обычно вызывает инфекции кожи и мягких тканей и устойчив ко многим антибиотикам.Хотя ранее MRSA был в основном патогеном, приобретаемым в больницах, его заболеваемость в обществе растет, и он стал наиболее частой причиной инфекций кожи и мягких тканей, поступающих в отделения неотложной помощи в Соединенных Штатах. Существует ограниченное количество антибиотиков, одобренных для лечения MRSA, и их частое использование привело к появлению бактерий с множественной лекарственной устойчивостью. Таким образом, мы считаем, что существует значительная неудовлетворенная медицинская потребность в новых антибиотиках, таких как аварофлоксацин, которые обеспечивают гибкие (стационарные и амбулаторные) варианты лечения MRSA.
WO-2006/101603 описывает 7-аминоалкилиденил-гетероциклические хинолоны как противомикробные соединения и синтез 7 — [(3E) -3- (2-амино-1-фторэтилиден) -1-пиперидинил] -1-циклопропил-6. -фтор-1,4-дигидро-8-метокси-4-оксо-3-хинолинкарбоновая кислота описана как соединение (303) в Таблице 1 на странице 20. Это соединение обычно обозначается как соединение «А» в дальнейшем.
соединение «А»
7 — [(3E) -3- (2-амино-1-фторэтилиден) -1-пиперидинил] -1-циклопропил-6-фтор-1,4-дигидро-8-метокси-4-оксо-3-хинолинкарбоновая кислота
Антибактериальные свойства соединения «А» in vitro описаны Морроу Б.J. et al. в Противомикробные агенты и химиотерапия, т. 54, с. 1995 — 1964 (2010).
В заявке
WO-2008/005670 раскрыты однореакторные способы производства замещенных аллиловых спиртов, а также методы экстракции для разделения определенных изомерных спиртовых продуктов, которые можно использовать для получения хинолонов, таких как антимикробное соединение 7 — [(3E) -3. — (2-амино-1-фторэтилиден) -1-пиперидинил] -1-циклопропил-6-фтор-1,4-дигидро-8-метокси-4-оксо-3-хинолинкарбоновая кислота (то есть соединение »).Важным промежуточным продуктом в общем пути синтеза указанного противомикробного соединения ‘A’ является 2 — [(2E) -2-фтор-2- (3-пиперидинилиден) этил] -1H-изоиндол-1,3 (2H) -дион и его соль соляной кислоты: соединение (1)
Соединение 2 — [(2E) -2-фтор-2- (3-пиперидинилиден) этил] -1H-изоиндол-1,3 (2H) -диона (1) .HCI
Соединение (1) вносит желаемую E-стереохимию в общий путь синтеза противомикробного соединения «».
WO-2008/005670 раскрывает путь синтеза соединения (1) на странице 38, как показано ниже:
— высокообогащенный (E)
(Шаг 3a) O
Подробная процедура реакции для соединения (1) раскрыта в WO-2008/005670 в примере 1 на страницах 37-44 с получением соединения (1) в методе A с соотношением E: Z 97: 3 с приблизительным общим выходом 18% в методе A (стадия 1 для первых 3 слоев гептана дает выход 34% при соотношении E: Z 71: 29, стадия 2a дает выход 53.4% с соотношением E: Z 97: 3, и стадия 3 имеет количественный выход), или с получением соединения (1) в методе B с приблизительным общим выходом 15% с соотношением E: Z 94,4: 5,6. WO-2008/005670 раскрывает способ синтеза аддитивной соли соляной кислоты соединения (1) на странице 15 схемы 2, как показано ниже:
в н-бутанол,
1) 5/6 N HCl в IPA
2) нагрев до перегонки
3) добавить IPA
E-изомер, обогащенный
соединение (1).HCl
Подробная процедура реакции для получения HCl-соли соединения (1) раскрыта в WO-2008/005670 в примере 4 на страницах 49-52, что дает> 95% желаемого E-изомера с общим выходом 18-22%, исходный. из N-boc-3-пиперидона.
Процедуры реакции, описанные в WO-2008/005670 для получения соединения (1) или его HCl-соли, характеризуются отсутствием селективности реакции Уодсворта-Эммонса-Хорнера, которая дает нежелательный Z-изомер в больших количествах.Этот нежелательный Z-изомер требует дополнительных затратных по времени этапов разделения.
Следовательно, существует потребность в более эффективном и менее образующем отходе способе получения соединения (1) или его соли HCl. WO-2010/056633 раскрывает схему синтеза XIV на странице 87 для получения трет-бутил-4- (2-этокси-2-оксоэтилиден) пиперидинил-1-карбоксилата и схему синтеза XXVI на странице 111 для получения (1-бензил-пиперидина Этиловый эфир -4-илиден) бромуксусной кислоты.
В первом варианте осуществления настоящее изобретение относится к улучшенному способу получения соединений формулы (III), имеющих улучшенное соотношение желаемого (E) -изомера по сравнению с нежелательным (Z) -изомером.
(I)
В следующем воплощении соединение (E) — (III) затем превращается в соединение (1) или его аддитивную соль с соляной кислотой.
………………………… ..
WO 2008005670
http://www.google.com/patents/WO2008005670A2?cl=en
Схема 1
3 экв. NaBH 4 OH
30 — 4O 0 С
2a 2b 2a
2b показывает приготовление спирта 2
Схема 2
1) HCI (5 экв.)
водный слой до обогащенного изомера E pH 9-10, затем экстрагируют н-бутанолом, водный слой отбрасывают
Препарат
7- [3- (2-амино-1-фторэтилиден) пиперидин-1-ил] -1-циклопропил-6-фтор-8-метокси-4-оксо-1,4-дигидрохинолин-3-карбоновая кислота (10 ) и его соль HCl (12)
7- [3- (2-амино-1-фторэтиден) пиперидин-1-ил] -1-циклопропилфтор-8-метокси-4-оксо-1,4-дигидро-хинолин-3-карбоксил кислота (10)
Стадия 1. Получение трет-бутилового эфира 3- (1-фтор-2-гидроксиэтилиден) пиперидин-1-карбоновой кислоты (2a)
В четырехгорлую круглодонную колбу объемом 22 л, оснащенную термопарным контроллером, верхней механической мешалкой, конденсатором, переходником для впуска азота и пробкой, загружали N-Boc-3-пиперидон (663.36 г, 3,34 моль), 2-метоксиэтанол (6,0 л) и 2-фтортриэтилфосфоноацетат (843,54 г, 3,49 моль). Смесь перемешивали до получения гомогенного раствора, а затем добавляли CS 2 CO3 порциями в течение 1,5 часов. После завершения добавления CS 2 CO 3 , порциями в течение 6 часов добавляли NaBH 4 ; в течение большей части этого добавления температура реакции поддерживалась в диапазоне от 35 0 ° C до 40 0 ° C. После завершения добавления реакционной смеси давали возможность перемешиваться в течение ночи, после чего анализ ВЭЖХ показал, что реакция завершилась.Этот цикл был объединен с двумя дополнительными циклами равного размера и перенесен в 100-литровый реактор Hastalloy® с перемешиванием, содержащий воду (90 л). Водную смесь экстрагировали гептаном (4 х 20 л) с последующей экстракцией МТВЕ (метил-трет-бутиловым эфиром) (20 л). Первые три экстракта гептана дали 842 г аллилового спирта в виде смеси 71:29 (E: Z) (ВЭЖХ и ЯМР). Смесь продуктов из первых трех экстракций гептана переносили на следующую стадию без какой-либо дополнительной очистки.Четвертый гептановый экстракт дает 114 г продукта, который представляет собой смесь 67:33 следующих спиртов: Z (ЯМР). Экстракция и концентрирование MTBE дали 1,1 кг продукта в виде смеси спиртов E: Z (33:67) (ВЭЖХ). Общий общий выход для обоих изомеров составил 2,06 кг (83%). 1 H ЯМР 2a (400 МГц, CDCl 3 ): £ 1,45 (с, 9 H), 1,52 (м, 2 H), 2,40 (м, 2 H), 3,45 (м, 2 H), 3,90 (с, 2 H), 4,25 (д, 2 H). 1 H ЯМР 2b (400 МГц, CDCl 3 ): δ 1,46 (с, 9 H), 1,65 (м, 2 H), 2.27 (м, 2 H), 3,45 (м, 2 H), 4,1 (с, 2 H), 4,25 (д, 2 H).
Стадия 2, метод A. Получение трет-бутилового эфира 3-из- [2- (1,3-диоксо-1,3-дигидроизоиндол-2-ил) -1-фторэтилиден] пиперидин-1-карбоновой кислоты ( 3-)
В четырехгорлую круглодонную колбу объемом 22 л, оснащенную контроллером термопар, верхней механической мешалкой, конденсатором, капельной воронкой для выравнивания давления, переходником для впуска азота и пробкой, загружали смесь спирта E: Z 2a и 2b (377,5 г, 1,296 моль исправлено), 2-MeTHF (3.31 л), фталимида (232,8 г, 1,581 моль) и Ph 3 P (411,3 г, 1,568 моль). Белую суспензию перемешивали под N 2 и охлаждали до -12 0 ° C на бане ацетон / сухой лед, добавляли DIAD (309 мл, 1,49 моль) через капельную воронку в течение 36-минутного периода, в то время как температуру реакции поддерживали от -15 0 ° C до -10 0 ° C. После добавления реакционную смесь нагревали до 20 0 ° C на водяной бане и перемешивали в течение 2 часов. Реакционную смесь охлаждали до 0 0 ° C на бане лед / вода и гасили холодным 1.0 M HCl (950 мл). Водную фазу отделяли и к органической фазе добавляли EtOAc (1,70 л). Эту фазу промывали холодной 1,0 М HCl (0,95 л) (водная фаза имела pH <2) и затем разделяли. Затем органическую фазу промывали холодным 4 н. NaOH (1,70 л), щелочную водную фазу (pH> 13) отделяли и слой EtOAc промывали рассолом (1,70 л). Концентрирование органической фазы при 60 0 ° C в условиях внутреннего вакуума (-120 мм рт. Ст.) Дало 1 442,0 г сырого вещества 3. Этот прогон повторяли в том же масштабе, чтобы получить еще 1 431.0 г сырого материала с общим выходом 2873 г (159%). Анализ ВЭЖХ (% площади) показал, что неочищенный продукт 3 был смесью 3-E (29,4%), 3-Z (10,4%), Ph 3 PO (51,0%) и фталимида (1,1%). Его очищали перекристаллизацией, как описано на стадии 2а.
Стадия 2а, метод А. Очистка трет-бутилового эфира 3-из- [2- (1,3-диоксо-1,3-дигидроизоиндол-2-ил) -1-фторэтилиден] пиперидин-1-карбоновой кислоты
В четырехгорлую круглодонную колбу объемом 22 л, оснащенную термопарным контроллером, расположенной наверху механической мешалкой, конденсатором, капельной воронкой для выравнивания давления, переходником для впуска азота и пробкой, загружали объединенное сырье 3 (2873 г) и MeOH (9.0 л). Раствор перемешивали в атмосфере азота и нагревали до 65 0 ° C, в то время как горячий (60 0 ° C) D.I. воду (7,8 л) добавляли в течение 15 минут. Раствор перемешивали при 65 0 ° C в течение 5 минут, затем кожух заменяли водяной баней, и смесь постепенно охлаждали до 0 0 ° C в течение 4-часового периода и продолжали перемешивание в течение 1 часа. ч при 0 0 ° С. Беловатое твердое вещество собирали фильтрованием и сушили отсасыванием воздуха при 60 0 ° С в течение 20 часов, что дало 1172.6 г смеси 3-E и 3-Z.
Вышеупомянутый частично очищенный продукт перекристаллизовывали второй раз таким же образом, используя горячий МеОН (7,2 л) и горячую воду (5,0 л), за исключением того, что воду добавляли в течение 10-минутного периода с получением 515,6 г (53,4%) 3-E в виде смеси 97: 3 геометрических изомеров E: Z. Этот материал использовали на следующем этапе без дополнительной очистки. . 1 H ЯМР 3-E (400 МГц, CDCl 3 ): δ 1,48 (с, 9 H), 1,52-1,66 (м, 2 H), 2,28-2,38 (м, 2 H), 3.40-3,51 (м, 2 H), 4,18 (с, 2 H), 4,55 (д, J = 21,0 Гц, 2 H), 7,68-7,77 (м, 2 H), 7,80-7,89 (м, 2 H) . МС: 397 (M + Na) + , 771 (2M + Na) + .
Трет-бутиловый эфир 3 -E- [2- (1,3-диоксо-1,3-дигидроизоиндол-2-ил) -1-фторэтилиден] пиперидин-1-карбоновой кислоты был также получен с помощью метода B, описанного ниже: стадия 2, Метод B. Получение трет-бутилового эфира 3- £ — [2- (1,3-диоксо-1,3-дигидроизоиндол-2-ил) -1-фторэтилиден] пиперидин-1-карбоновой кислоты (3- E)
Получение метансульфонатных и хлоридных производных
2a
В 4-горлую круглодонную колбу объемом 12 л, оснащенную верхней мешалкой, термопарой, капельной воронкой для выравнивания давления и переходником для впуска азота, загружали 2a (297.0 г, 1,21 моль) и CH 2 Cl 2 (3,9 л). Раствор охлаждали до 0 0 ° C в атмосфере N 2 и добавляли EtsN (320 мл, 2,30 моль) через капельную воронку в течение 10 минут. Затем добавляли метансульфонилхлорид (115 мл, 1,49 моль) в течение 60-минутного периода, затем реакционную смесь перемешивали еще 60 минут при 0,-0, ° C. Смесь выливали в смесь деионизированной воды (4,4 L) и насыщенного NaHCθ3 (0,78 л), слои разделяли, водный слой экстрагировали CH 2 Cl 2 (2 × 2 л).Все слои CH 2 Cl 2 объединяли и промывали насыщенным NaHCO3 (2 л). CH 2 Cl 2 удаляли в вакууме при 40 0 ° C с получением смеси мезилата и хлорида (342,3 г). Эту смесь использовали на следующем этапе без какой-либо очистки.
Превращение метансульфоната / хлорида в фталимид 3
В 4-горлую круглодонную колбу на 5 л, оснащенную верхней мешалкой, термопарой, капельной воронкой для выравнивания давления и переходником для впуска азота, загружали смесь мезилата и хлорида, полученную сверху (342.2 г, 1,21 моль) и ДМФ (2,0 л), а затем фталимид калия (224,9 г, 1,21 моль). Смесь перемешивали при 60 0 ° C в течение 1 часа, затем при 20 0 ° C в течение 18 часов. Смесь выливали в ледяную воду, выдерживали 30 мин и фильтровали. Щелокам после фильтрации давали постоять при 0 0 ° C в течение выходных и снова фильтровали. Объединенные твердые вещества растворяли в ацетоне (4 л) и концентрировали на роторном испарителе, этот процесс повторяли второй раз с получением производного фталимида 3 в виде смеси изомеров EIZ (79/31) (263.2 г, 58,1%).
Стадия 2а, метод В. Очистка трет-бутилового эфира 3- £ — [2- (1,3-диоксо-1,3-дигидроизоиндол-2-ил) -1-фторэтилиден] пиперидин-1-карбоновой кислоты
В четырехгорлую круглодонную колбу объемом 12 л, оснащенную подвесной мешалкой, термопарой, капельной воронкой для выравнивания давления и адаптером для впуска азота, загружали неочищенное производное фталимида 3 (263,1 г) и МеОН (2,74 л). Смесь нагревали до 66-68 0 ° C при добавлении воды (2,1 л) в течение 20 минут, смесь перемешивали при 68 0 ° C в течение 5 минут, затем постепенно охлаждали до 20 0 ° C в течение 18-ч.Пока смесь для кристаллизации охлаждалась, ее засевали при 60 0 ° C, 56 0 ° C и 53 0 ° C. Эта кристаллизация дала белое твердое вещество, которое фильтровали и сушили в вакууме при 50 0 ° C с получением 3 -E (118,8 г, 45,2%) в виде смеси, содержащей 94,4% E и 5,6% Z-изомеров (анализ ЯМР).
Стадия 3. Получение 2- [2-фтор-2- (3-пиперидинилиден) этил] -1Н-изоиндол-1,3) — диона (4)
В 4-горлую круглодонную колбу объемом 12 л, оснащенную верхней мешалкой, термопарой, капельной воронкой для выравнивания давления и переходником для впуска азота, загружали 3-E (578.0 г, 1,544 моль) и CH 2 Cl 2 (4,5 л). Раствор перемешивали при 20 0 ° C в атмосфере N 2 и добавляли TFA (476 мл, 6,18 моль) через капельную воронку в течение 10-минутного периода. Смесь осторожно нагревали до 38 -0 ° C и перемешивали в течение 3 часов. Растворитель удаляли в вакууме, получая соль TFA 4 (962,6 г). Этот материал растворяли в CH 2 Cl 2 (4,0 л) и промывали 2,5 NNa 2 CO 3 (4,6 л), а затем насыщенным NaHCO 3 (4.6 л). Органическую фазу сушили (MgSO 4 ), фильтровали и конденсировали в вакууме. Не совсем белое твердое вещество сушили при 40 0 ° C в вакууме (20 мм рт. Ст.) В течение 20 часов с получением 464,3 г свободного основания 4 в виде слегка желтоватого пенистого вещества. 1 H ЯМР 4 TFA соли (400 МГц, CDCl 3 ): δ 1,87-1,98 (м, 2 H), 2,42-2,55 (м, 2 H), 3,38-3,50 (м, 2 H), 4,08-4,18 (шир. С, 2 H), 4,50 (д, J = 21,0 Гц, 2 H), 7,69-7,78 (м, 2 H), 7,79-7,87 (м, 2 H), 7,98-8,23 (шир. С , 1 Н), 12.- дифторборатный эфир дигидрохинолин-3-карбоновой кислоты (6)
В четырехгорлую круглодонную колбу объемом 22 л, оснащенную верхней мешалкой, термопарой, конденсатором, капельной воронкой для выравнивания давления и адаптером для впуска азота, загружали хинолин-3-карбоновую кислоту 5 (450,0 г, 1,524 моль), ТГФ. (5,40 л) и K 2 CO 3 (247,2 г, 1,753 моль). Эту суспензию сначала перемешивали при 20 0 ° C под N 2 в течение 5 минут и BF 3 » Et 2 0 (259 мл, 2.04 моль) по каплям через капельную воронку добавляли к перемешиваемой смеси в течение 5-минутного периода. После добавления смесь кипятили с обратным холодильником (66 0 ° C) в течение 6 часов. Реакционную смесь охлаждали до 10 0 ° C, разбавляли Et 2 O (9,0 л) и перемешивали в течение 10 минут. Твердое вещество фильтровали и промывали Et 2 O (200 мл x 2), а затем сушили при 50 0 ° C в домашнем вакууме (-160 мм рт. Ст.) В течение 20 часов с получением 771,0 г сырого дифторборатного эфира 6. После этого неочищенный материал суспендировали в MeCN (8.0 л) и перемешивали при 20 0 ° C в течение 20 минут; твердое вещество собирали фильтрацией. Осадок на фильтре ресуспендировали и перемешивали в MeCN еще четыре раза (2,0 л × 4), и все фильтраты объединяли и концентрировали при 60 -0 ° C в условиях высокого вакуума (~ 10 мм рт. Ст.). Полученное твердое вещество грязно-белого цвета сушили при 50--0- ° C под домашним вакуумом (-160 мм рт. Ст.) В течение 20 часов с получением 508,66 г (выход выделения 97,2%, ВЭЖХ = 99,2% по площади) чистого сложного эфира дифторбората 6. 1 H ЯМР 6 (400 МГц, CD 3 CN): «51.17-1,28 (м, 2 H), 1,29-1,40 (м, 2 H), 4,19 (с, 3 H), 4,40-4,52 (м, 1 H), 8,16 (дд, J = 6,9, 7,0 Гц, 1 H), 9,17 (с, 1 H). МС: 344 (МН) + , 667 (2М-Ж) + .
Этап 5: Приготовление промежуточного звена 8
В 4-горлую круглодонную колбу объемом 5 л, оснащенную верхней мешалкой, термопарой, конденсатором, капельной воронкой для выравнивания давления и адаптером для впуска азота, загружали дифторборатный эфир 6 (320,0 г, 0,933 моль), ДМФ (1,10 л). и пиперидин 4 (289,0 г, 1.053 моль). Эту суспензию перемешивали при 20 0 ° C под N 2 в течение 5 минут, EtsN (299 мл, 2,15 моль) добавляли к перемешиваемой смеси через капельную воронку в течение дополнительного 5-минутного периода. После этого добавления смесь нагревали до 60 0 ° C и перемешивали в течение 3 часов с получением сырого промежуточного соединения 7. Анализ ВЭЖХ (% площади) показал, что неочищенный продукт 7 представляет собой смесь 7 (40,5%), 8 (1,7%). , 6 (24,1%), а остальные неизвестные (33,7%). МС: 598 (МН) + . Связанный сырой продукт 7 без выделения переносили на следующую стадию.
Удаление сложного эфира фторбората. Вышеуказанную перемешиваемую реакционную смесь, содержащую 7, обрабатывали в той же колбе EtOH (6,80 л) и Et 3 N (299 мл, 2,147 моль) под N 2 при 60 0 ° C. Янтарный раствор нагревали с обратным холодильником при 72 0 ° C в течение 2 часов и охлаждали до 20 0 ° C. Реакционную смесь выливали в быстро перемешиваемую четырехгорлую круглодонную колбу объемом 22 л, содержащую 1: 1 (v / v) смесь льда с водой (8,0 л) в течение 10-минутного периода; перемешивание продолжали в течение -10 мин.К раствору добавляли холодный 1 NHCl (4,0 л) в течение 20 минут, чтобы довести pH от 9-10 до 3; перемешивание продолжали в течение дополнительных 20 минут при 0 0 ° C. Желтое твердое вещество выделяли фильтрованием и сушили в фильтровальной воронке путем отсасывания воздуха с использованием домашнего вакуума (-160 мм рт. с получением 1889,0 г сырого продукта 8 в виде влажного твердого вещества (ВЭЖХ = 33,6%,% площади).
Очистка промежуточного продукта 8
В четырехгорлую круглодонную колбу объемом 22 л, оснащенную верхней мешалкой, термопарой, капельной воронкой для выравнивания давления и переходником для впуска азота, загружали сырую нефть 8 (1889 г.0 г), MeCN (3,6 л) и EtOH (3,2 л). Суспензию кипятили с обратным холодильником (76 0 ° С), в то время как Д.И. H 2 O (500 мл) добавляли в течение 10 минут. Раствор перемешивали при 76 0 ° C в течение 5 минут, а затем постепенно охлаждали до 10 0 ° C в течение 1 часа; перемешивают еще час. Желтое твердое вещество собирали фильтрованием, сушили в вакуумной печи под домашним вакуумом (-160 мм рт. Ст.) При 60 0 ° C в течение 20 часов с получением 229. Ig (45%) 8, который использовали на следующей стадии без дальнейшая очистка. 1 H MR 8 (400 МГц, ДМСО-d 6 ): 1,02-1,10 (м, 2 H), 1,11-1,19 (м, 2 H), 1,67-1,79 (м, 2 H), 2,34-2,45 (м, 2 H), 3,38-3,49 (м, 2 H), 3,78 (с, 3 H), 4,10 (с, 2 H), 4,15-4,26 (м, 1 H), 4,54 (д, J = 21,0 Гц, 1 H), 7,72 (д, J = 9,1 Гц, 1 H), 7,81 (с, 4 H), 8,71 (с, IH), 14,98 (с, 1 H). МС: 550 (МН) + .
Стадия 6. Получение 7- [3- (2-амино-1-фторэтилиден) пиперидин-1-ил] -1-циклопропил-6-фтор-8-метокси-4-оксо-1,4- дигидро-хинолин-3-карбоновая кислота (10)
8 10 А
В четырехгорлую круглодонную колбу объемом 22 л, оснащенную подвесной мешалкой, термопарой, конденсатором, капельной воронкой для выравнивания давления и переходником для впуска азота, загружали 8 (253.6 г, 0,462 моль) и MeOH (5,10 л). Эту суспензию перемешивали при 20 0 ° C под N 2 и добавляли H 2 NNH 2 (86,9 мл, 2,796 моль) в течение 5-минутного периода. Желтую суспензию нагревали до 65 -0 ° C и кипятили с обратным холодильником в течение 1 часа. Реакционную смесь охлаждали до 60 -0 ° C и добавляли MeCN (3,84 л). Смесь кипятили с обратным холодильником в течение 5 мин, а затем охлаждали до 20 0 ° C на водяной бане. Светло-желтое твердое вещество собирали фильтрованием и осадок на фильтре промывали MeCN (150 мл × 2).Объединенный фильтрат концентрировали при 60 0 ° C, получая 322,0 г сырого продукта 10. Этот продукт перекристаллизовывали из смеси MeOH (1,0 л) и воды (1,195 л), получая 176,6 г (91,2%) чистого продукта 10. в виде светло-желтого твердого вещества.
БАЗОВАЯ ФОРМА
1 H ЯМР 10 (400 МГц, ДМСО-d 6 ): £ 1,0-1,09 (м, 2 H), 1,10-1,19 (м, 2 H), 1,66-1,78 (м, 2 H), 2,30-2,41 (м, 2 H), 3,17 (с, 2 H), 3,35 (с, 1 H), 3,36-3. 47 (м, 2 H), 3.74 (с, 3 H), 3,89 (с, 2 H), 4,13-4,22 (м, 1 H), 5,35-6,18 (широкий, 2 H), 7,74 (д, J = 8,9 Гц, 1 H), 8,69 (с, 1 H).
МС: 420 (MH) + .
Пример 3
Получение 7- [3- (2-амино-1-фторэтилиден) пиперидин-1-ил] -1-циклопропил-
Хлороводородная соль 6-фтор-8-метокси-4-оксо-1,4-дигидро-хинолин-3-карбоновой кислоты (12)
7- [3- (2-амино-1-фторэтилиден) пиперидин-1-ил] -1-циклопропил-6-фтор-8-метокси-4-оксо-1,4-дигидрохинолин-3 -карбоновую кислоту (10) получали, как описано на стадии 6 примера 1.
В 4-горлую круглодонную колбу объемом 5 л, оснащенную верхней мешалкой, термопарой, конденсатором, капельной воронкой для выравнивания давления и переходником для впуска азота, загружали соединение 10 (176,0 г, 0,4196 моль) и EtOH (2,40 л). . Суспензию перемешивали под N 2 и охлаждали до 10 0 ° C на бане лед / вода. Раствор HCl в EtOH (1,25 M, 350 мл) добавляли через капельную воронку в течение 20-минутного периода. После добавления реакционную смесь перемешивали при 10 0 ° C в течение 5 минут.Водяная баня была заменена нагревательным кожухом, и раствор был нагрет до 76 -0 ° C и перемешивался в течение 5 минут. Нагревательный кожух заменяли на водяную баню, раствор охлаждали до 0 -0 ° C в течение 1 часа и перемешивали при этой температуре еще 1 час. Твердое вещество собирали фильтрованием, промывали ледяным EtOH (100 мл × 2) и сушили при 60 -0 ° C в вакууме (~ 4 мм рт. Ст.) В течение 60 часов. Было получено 88,9 г (82%) соли HCl 12 в виде твердого вещества от грязно-белого до очень светло-желтого цвета.
СОЛЬ HCl
1 H ЯМР HCl соли 12 (400 МГц, CD 3 CO 2 D): £ 1,10-1,19 (м, 2 H), 1,29-1,38 (м, 2 H), 1,81- 1,93 (м, 2 H), 2,51-2,60 (м, 2 H), 3,48- 3,60 (м, 2 H), 3,86 (с, 3 H), 4,08 (с, 2 H), 4,18 (с, 1 H) ), 4,19-4,30 (м, 2 H), 7,92 (д, J = 8,6 Гц, 1 H), 8,98 (с, 1 H), 11,65 (с, 1 H).
МС: 420 (MH) +
………………………………………
http: // www.google.com/patents/WO2013045599A1?cl=en
Эксперимент 6
(VI) соединение (1) .HCI
Соединение (1). Соль HCI из соединения (Via):
9,8 мл (90,6 ммоль) 1-хлорэтилхлорформиата медленно добавляют к раствору 30 г (82,3 ммоль) соединения (E) — (Va) в 165 мл толуола при температуре 0 ° C. Реакционную смесь перемешивают 1 час при комнатной температуре, чем 1 час при 80 ° C, и фильтруют. К фильтрату добавляют 24 мл этанола и 15,35 мл (90,6 ммоль) 6 М раствора HCl в изопропаноле, и полученную смесь кипятят с обратным холодильником в течение 4 часов, затем охлаждают до 0 ° C.Осадок фильтруют, промывают 16 мл ацетона и 16 мл толуола и сушат в вакууме, получая 21,94 г соединения (1). Соль HCl. Выход: 86%>.
Данные
ЯМР и МС идентичны литературным.
- [PDF]
Непатентованное лекарственное средство гидрохлорид аварофлоксацина наименование
http://www.ama-assn.org/resources/doc/usan/ аварофлоксацин -hydrochloride.pdf
WO2006101603A1 2 февраля 2006 г. 28 сентября 2006 г. Янссен Фармацевтика НВ 7-аминоалкилиденилгетероциклические хинолоны и нафтиридоны WO2008005670A2 14 июня 2007 г. 10 янв.2008 г. Янссен Фармацевтика НВ Способы однореакторного восстановления путем конденсации для получения замещенных аллиловых спиртов WO2010056633A2 10 нояб.2009 г. 20 мая 2010 г. Янссен Фармацевтика НВ 7-аминоалкилиденилгетероциклические хинолоны и нафтиридоны
Обновления COVID-19: мероприятие, назначенное LVC для фазы 1
Диск-гольф Pro Tour и сотрудники LVC завершили рассмотрение того, что конкурс 2021 Las Vegas Challenge, представленный Innova, будет в Фазе 1 политики DGPT COVID-19. .
Кроме того, DGPT может подтвердить, что ежегодные благотворительные мероприятия Waco Open и The Open at Belton подтверждены и перейдут к заключительным этапам планирования. Обозначение фазы каждого мероприятия будет установлено за две недели до каждого мероприятия, соответственно.
Что касается деталей LVC, фазы 1, ознакомьтесь с обзором политик и передовых методов фазы 1, который будет действовать ниже:
Обзор политики и передовых практик COVID-19 фазы 1
Las Vegas Challenge, 25-28 февраля 2021 г., гольф-клуб Wildhorse, Хендерсонвилл, NV
Ниже приводится обзор Политики и передового опыта, применяемых для проведения соревнований Las Vegas Challenge в гольф-клубе Wildhorse. Это мероприятие будет проводиться в рамках фазы 1 требований и рекомендаций по COVID-19 для серии PDGA Elite. В этом обзорном документе представлены важные основные моменты полной политики для более быстрого ознакомления. Для получения всей информации о политике DGPT COVID-19 посетите веб-страницу обзора DGPT COVID.
Политика штата Невада в отношении COVID-19
DGPT и все связанные с ним события соответствуют всем политикам и рекомендациям PDGA, государственным и местным COVID-19. Что касается Las Vegas Challenge, штат Невада одобрил заявку Disc Golf Pro Tour на проведение мероприятия в соответствии с политикой штата и Документом о политике и передовой практике DGPT Elite Series в отношении COVID-19.
LVC и DGPT решили, что это мероприятие будет проходить в рамках Фазы 1 Политики DGPT COVID-19, что означает отсутствие зрителей или кэдди. Это позволит мероприятию оставаться в соответствии с государственной политикой. Чтобы прочитать о текущих рекомендациях и информации о COVID-19 в штате Невада, перейдите по ссылкам ниже:
Обзор фазы 1 политики и передового опыта в отношении COVID-19 для LVC:
- Вход на сайт событий и протоколы
- ВИКТОРИНА НА СООТВЕТСТВИЕ СООТВЕТСТВИЮ DGPT COVID-19
- Все лица (участники, сотрудники, волонтеры, представители СМИ), приходящие на место проведения мероприятия, должны пройти тест на соответствие требованиям DGPT COVID-19, чтобы убедиться в понимании и обязательстве следовать всем политикам места проведения мероприятия в отношении COVID-19.
- начнутся в понедельник, 22 февраля, после того, как будет создан официальный сайт мероприятия, и продолжатся до последнего дня мероприятия, воскресенья, 28 февраля.
- предназначены для всех лиц, заходящих на место проведения мероприятия, и состоят из следующего:
- Всех просят ограничить время прибытия не ранее, чем за 1 час до начала занятий или начала смены (сотрудники / волонтеры / СМИ). Все сотрудники и СМИ могут гарантировать, что у них будет достаточно времени для подготовки на месте.
- Всех людей остановят и попросят предъявить свой значок с идентификатором мероприятия (или предоставить идентификатор и забрать свой значок).
- Все люди должны поговорить с персоналом места входа и не иметь видимых симптомов респираторного заболевания (кашель или явное заболевание). Согласно штату Невада, все люди должны пройти проверку температуры, чтобы попасть на место проведения мероприятия.
- Все люди должны подтвердить, что у них не было никаких симптомов респираторного заболевания и что они не контактировали с кем-либо с симптомами COVID-19 в течение последних десяти дней.
- Всем участникам предлагается покинуть место проведения мероприятия не позднее, чем через 30 минут после их обхода / смены.
- Если люди хотят оставаться на месте дольше, они должны запросить специальное разрешение на наблюдение после раунда / смены.
Протоколы места проведения мероприятия
Протоколы событий
- Активная программа тестирования и отслеживания
- Полная политика предоставляется конкурентам, персоналу, волонтерам и СМИ.
- Тестирование требуется всем лицам, входящим в места событий с признаками, симптомами или недавним контактом (за последние десять дней) с кем-то, у кого был положительный результат теста на COVID-19.
- Программа отслеживания контактов, внедренная и управляемая DGPT для путешествующих лиц.
- Любое необходимое тестирование на COVID-19 предоставляется бесплатно для всех участников мероприятия.
- Социальная дистанция
- Будет принудительно установлено социальное дистанцирование на 2 метра.
- Сюда не входит физическое прикосновение к другим людям, их оборудованию или их личным вещам.
- PDGA, любезность 812, в силе, и следующий дополнительный язык будет добавлен и применен на этапах 1 и 2 событий DGPT:
- «Игроки не должны нарушать политику социального дистанцирования — 2 метра без маски»
Правило
- Без кедди
- Только участники, СМИ и необходимый персонал и волонтеры будут допущены в пределах 50 футов от ти и грина
- На одного участника разрешается один командировочный / вспомогательный персонал
- Каждому участнику будет разрешено взять с собой одного командировочного / вспомогательного персонала на место проведения мероприятия, если это необходимо.
- Весь командировочный / вспомогательный персонал должен будет зарегистрироваться не позднее пятницы, 19 февраля.
- Командировочный / вспомогательный персонал не будет допущен на место без предварительного разрешения.
- Весь командировочный / вспомогательный персонал должен соблюдать все протоколы COVID-19 на месте проведения мероприятий.
- Политика прикрытия лица (этапы 1 и 2)
- Все следующие инструкции применимы ко всем лицам, находящимся на месте проведения мероприятия:
- Все люди должны постоянно носить утвержденную маску для лица.
- В помещении все люди должны носить защитные маски.
- Когда вы находитесь на улице и можете находиться на некоторой дистанции, защитное покрытие лица будет настоятельно рекомендовано, но не обязательно (за исключением 50 футов от зоны ти, см. Ниже).
- Зона ти: Все люди, включая спортсменов, должны носить защитную маску, когда находятся в пределах 50 футов от зоны ти.
- Когда наступает очередь участника бросать, ему разрешается снять защитную маску с лица во время броска.
- В специально отведенных местах, таких как точки защемления, зоны разминки и все внутренние помещения, все люди должны носить маску независимо от социального дистанцирования.
- На улице и в местах, где невозможно социальное дистанцирование на 2 метра, все люди должны носить защитные маски.
- Весь персонал и волонтеры на поле должны носить маскировку для лица при общении на близком расстоянии с игроками в пределах 10 метров.
- Зрителям запрещено
- Обратите внимание: если сотрудники мероприятия, волонтеры, СМИ или участники желают остаться на месте после своей смены для просмотра, они могут запросить разрешение на это.Все лица, оставшиеся на месте для просмотра, должны пройти регистрацию в Tourney Central, следовать предоставленным инструкциям, держаться подальше от ти и грина и придерживаться специально отведенных мест для просмотра соревнований.
Передовой опыт
- Соблюдайте правила гигиены
- Используйте дезинфицирующее средство для рук (дезинфицирующее средство для рук входит в комплект большинства футболок и наборов игроков)
- Дезинфекция поверхностей (на всем предприятии имеются флаконы с дезинфицирующим спреем)
- Мойте руки до и после раунда
- Всегда носить маску для лица
GBT получает от Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (США) статус передового метода терапии для вокселотора для лечения серповидно-клеточной болезни (SCD)
Voxelotor является первым исследуемым препаратом для лечения ВСС, получившим обозначение прорывной терапии
ЮЖНЫЙ САН-ФРАНЦИСКО, Калифорния., 09 января 2018 г. (GLOBE NEWSWIRE) — Global Blood Therapeutics, Inc. (GBT) (NASDAQ: GBT) сегодня объявила, что Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) присвоило voxelotor (ранее называется GBT440) для лечения серповидно-клеточной анемии (SCD). Voxelotor разрабатывается как модифицирующая болезнь терапия для SCD и ранее был отмечен Европейским агентством по лекарственным средствам (EMA) Priority Medicines (PRIME) для лечения SCD.
«Решение FDA предоставить voxelotor первое обозначение прорывной терапии для лечения серповидно-клеточной анемии отражает признание многообещающих данных об эффективности и безопасности, которые мы собрали на сегодняшний день для этого исследуемого препарата, а также признание огромной потребности в значительный прогресс по сравнению с доступными методами лечения пациентов с внезапной сердечной смертью », — сказал Тед У.Любовь, президент и главный исполнительный директор ББТ. «Это назначение — еще одна важная веха для GBT, поскольку мы работаем над ускорением разработки вокселотора».
FDA выборочно предоставляет BTD для ускорения разработки и обзора лекарств, которые продемонстрировали предварительные клинические данные, указывающие на возможность значительного улучшения по сравнению с доступной терапией. Решение BTD для вокселотора было основано на клинических данных, представленных в следующих исследованиях:
- Предварительные данные об эффективности и безопасности из части A исследования HOPE фазы 3 (GBT440-031)
- Фаза 1/2 исследования и открытое расширение у взрослых (GBT440-001 / 024)
- Текущее исследование фазы 2 HOPE-KIDS 1 с участием детей от 6 до 17 лет (GBT440-007)
- Опыт Compassionate Access у взрослых с тяжелой ВСС (не соответствует критериям исследования HOPE)
О серповидно-клеточной болезни (SCD)
SCD — это пожизненное наследуемое заболевание крови, вызванное генетической мутацией в бета-цепи гемоглобина, которая приводит к образованию аномального гемоглобина, известного как серповидный гемоглобин (HbS).В деоксигенированном состоянии HbS имеет склонность к полимеризации или связыванию вместе, образуя длинные жесткие стержни внутри красных кровяных телец (RBC). Полимерные стержни деформируют эритроциты, приобретая серповидную форму и становясь негибкими, что может вызвать закупорку капилляров и мелких кровеносных сосудов. Начиная с детства, пациенты с ВСС страдают от непредсказуемых и повторяющихся эпизодов или кризов сильной боли из-за блокирования кровотока к органам, что часто приводит к психосоциальным и физическим нарушениям. Это блокирование кровотока в сочетании с гемолитической анемией (разрушение эритроцитов) может в конечном итоге привести к повреждению многих органов и ранней смерти.
О Voxelotor при серповидно-клеточной болезни
Voxelotor (ранее называвшийся GBT440) разрабатывается как пероральный препарат для приема один раз в день для пациентов с SCD. Voxelotor работает за счет увеличения сродства гемоглобина к кислороду. Поскольку оксигенированный серповидный гемоглобин не полимеризуется, GBT считает, что вокселотор блокирует полимеризацию и, как следствие, серповидность эритроцитов. GBT считает, что вокселотор, потенциально способный восстановить нормальную функцию гемоглобина и улучшить доставку кислорода, может изменить течение SCD.Признавая острую необходимость в новых методах лечения ВСС, Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) предоставило Voxelotor Fast Track, Orphan Drug и Rare Pediatric Disease для лечения пациентов с SCD. Европейское агентство по лекарственным средствам (EMA) включило вокселотор в свою программу приоритетных лекарств (PRIME), а Европейская комиссия (ЕК) обозначила вокселотор как лекарственный препарат для сирот для лечения пациентов с ВСС.
GBT в настоящее время проводит оценку вокселотора в исследовании HOPE ( H emoglobin O xygen Affinity Modulation to Inhibit HbS P olym E ), клиническое исследование фазы 3 у пациентов в возрасте 12 лет и старше с SCD.Кроме того, вокселотор изучается в продолжающемся исследовании фазы 2a HOPE-KIDS 1 — открытом исследовании однократной и многократной дозировки у педиатрических пациентов (возраст от 6 до 17 лет) с SCD. HOPE-KIDS 1 оценивает безопасность, переносимость, фармакокинетику и исследовательский лечебный эффект вокселотора.
О GBT
GBT — это биофармацевтическая компания, работающая на клинической стадии, стремящаяся открывать, разрабатывать и предлагать инновационные методы лечения, которые вселяют надежду в сообщества недостаточно обслуживаемых пациентов.GBT разрабатывает свой ведущий продукт-кандидат, voxelotor, в качестве пероральной терапии серповидно-клеточной анемии один раз в день. Чтобы узнать больше, посетите www.gbt.com и следите за новостями компании в Twitter @GBT_news.
Заявления прогнозного характера
Заявления, которые мы делаем в этом пресс-релизе, могут включать утверждения, которые не являются историческими фактами и считаются прогнозными в значении Раздела 27A Закона о ценных бумагах 1933 года с поправками и Раздела 21E Ценных бумаг Закон о валютном обмене 1934 года с поправками.Мы намерены сделать эти прогнозные заявления, включая заявления относительно терапевтического потенциала и профиля безопасности вокселотора (ранее называвшегося GBT440), нашей способности реализовать и завершить наши планы клинических разработок вокселотора, нашей способности генерировать и сообщать данные из наших текущих и потенциальных будущие исследования вокселотора (включая наше текущее исследование фазы 3 HOPE и наше текущее исследование фазы 2a HOPE-KIDS 1), нормативный обзор и действия, касающиеся вокселотора, а также время этих событий, которые должны быть охвачены положениями о безопасной гавани для дальнейших действий. смотреть заявления, содержащиеся в Разделе 27A Закона о ценных бумагах и Разделе 21E Закона о фондовых биржах, и делать это заявление в целях соблюдения этих положений о безопасной гавани.Эти прогнозные заявления отражают наши текущие взгляды на наши планы, намерения, ожидания, стратегии и перспективы, которые основаны на информации, доступной нам в настоящее время, и на сделанных нами предположениях. Мы не можем гарантировать, что планы, намерения, ожидания или стратегии будут реализованы или достигнуты, и, кроме того, фактические результаты могут существенно отличаться от тех, которые описаны в прогнозных заявлениях, и будут зависеть от множества рисков и факторов, которые вне нашего контроля, включая, помимо прочего, риски того, что наши клинические и доклинические разработки могут быть отложены или прекращены по разным причинам, что результаты клинических испытаний могут быть предметом различных интерпретаций, что регулирующие органы могут не согласиться с нашими планами клинических разработок или требовать дополнительных исследований или данных для поддержки дальнейшего клинического исследования наших продуктов-кандидатов, что побочные эффекты, связанные с лекарственными средствами, могут наблюдаться при клинической разработке, и что данные и результаты могут не соответствовать нормативным требованиям или иным образом быть достаточными для дальнейшей разработки, нормативного обзора или утверждения, наряду с рисками, изложенными в нашем Годовом отчете по Форме 10 -K за финансовый год, закончившийся 31 декабря 2016 года, и в нашем Ежеквартальном отчете по форме 10-Q за квартал, закончившийся 30 сентября 2017 года, а также обсуждение потенциальных рисков, неопределенностей и других важных факторов в наших последующих подачах с U.S. Комиссия по ценным бумагам и биржам. За исключением случаев, предусмотренных законом, мы не берем на себя никаких обязательств по публичному обновлению каких-либо прогнозных заявлений, будь то в результате получения новой информации, будущих событий или иным образом.
Контактная информация:
Myesha Lacy (инвесторы)
GBT
650-351-4730
[email protected]
Джули Нормарт (СМИ)
W2O pure
415-946-1087
[email protected]
Global Blood Therapeutics, Inc.
Государств назначения, продления срока действия и подтверждения для европейских патентных заявок
Для европейских патентных заявок, поданных с 2009 года, все доступные государства-члены EPC назначаются путем уплаты одной пошлины за указание.
ЕПВ имеет ряд соглашений с другими странами. В соответствии с этими соглашениями европейская патентная заявка может быть факультативно «распространена» на эти страны (если таковые имеются) путем уплаты дополнительной пошлины.
Количество доступных государств-членов ЕПК и дополнительных стран зависит от даты подачи заявки или даты подачи заявки РСТ для заявок на региональной фазе.
Плата за указание
Для заявок на европейскую региональную фазу пошлина за указание должна (обычно) быть уплачена до крайнего срока перехода на европейскую региональную фазу. Это 31 месяц с самой ранней даты приоритета.
Для европейских патентных заявок, поданных непосредственно в ЕПВ, и для европейских выделенных заявок пошлина за указание должна быть уплачена в течение 6 месяцев после публикации отчета о европейском поиске.
По состоянию на июнь 2012 г. насчитывается 38 стран-участниц ЕПК.Это:
| Албания (AL) | Италия (IT) |
| Австрия (AT) | Лихтенштейн (LI) |
| Бельгия (BE) | Литва (LT) |
| Болгария (BG) | Люксембург (LU) |
| Швейцария (CH) | Латвия (LV) |
| Кипр (CY) | Монако (MC) |
| Чешская Республика (CZ) | Бывшая югославская Республика Македония (MK) |
| Германия (DE) | Мальта (MT) |
| Дания (DK) | Нидерланды (NL) |
| Эстония (EE) | Норвегия (NO) |
| Испания (ES) | Польша (PL) |
| Финляндия (FI) | Португалия (PT) |
| Франция (FR) | Румыния (RO) |
| Соединенное Королевство (GB) | Сербия (RS) |
| Греция (GR) | Швеция (SE) |
| Хорватия (HR) | Словения (SI) |
| Венгрия (HU) | Словакия (SK) |
| Ирландия (IE) | Сан-Марино (SM) |
| Исландия (IS) | Турция (TR) |
Плата за расширение
Заявка на европейский патент может быть продлена на одно или оба из двух состояний продления.Для этого необходимо внести плату за продление для каждого выбранного штата. Крайний срок уплаты каждой пошлины за продление такой же, как и крайний срок уплаты пошлины за указание.
Исторически было доступно больше состояний расширения. Это число уменьшилось по мере того, как страны-участницы стали государствами-членами, которые оплачиваются единой пошлиной за указание. Для выделенных заявок с более ранней датой подачи может быть доступно более двух состояний продления.
Комиссия за валидацию
В настоящее время ЕПВ имеет ряд соглашений со странами, называемых «Соглашения о валидации».Эти страны доступны в качестве состояний валидации для заявок, поданных в соответствующую дату или после нее. Сборы за валидацию действуют так же, как и сборы за продление.
Чтобы распространить европейскую патентную заявку на статус валидации, необходимо уплатить пошлину за валидацию для этого государства. Крайний срок уплаты каждого сбора за валидацию такой же, как и крайний срок уплаты сбора за указание.
Последствия уплаты пошлин за продление и валидацию
Если для страны уплачивается пошлина за продление или подтверждение, при выдаче европейского патента патентообладатель может подтвердить свой патент в этой стране, подав любые необходимые переводы и уплатив все необходимые пошлины.Этот процесс аналогичен получению патента в государствах-членах, таких как Испания или Италия, через ЕПВ.
Просрочка платежа
Крайний срок для оплаты всех без исключения пошлин за продление и валидацию совпадает с датой пошлины за указание. Поэтому вы должны сообщить нам, какие состояния продления и / или проверки необходимы, если таковые имеются, при указании платы за указание.
Мы не платим сборы за продление и проверку, если это не указано.
Если крайний срок пропущен, можно оплатить сборы за продление и проверку в течение льготного периода с надбавкой в размере 50%.
Льготный период короткий.
Если указание было оплачено вовремя, льготный период для уплаты пошлин за продление и валидацию с доплатой в течение двух месяцев после установленной даты. ЕПВ не сообщает нам об этом льготном периоде.
Если пошлина за указание не была уплачена вовремя, ЕПВ выдает уведомление об утрате прав в связи с неуплатой пошлины за указание. В уведомлении о потере прав устанавливается двухмесячный срок с момента уведомления для уплаты пошлины за указание при дальнейшей обработке.Любые сборы за продление и проверку могут быть оплачены (за дополнительную плату) в течение периода дальнейшей обработки.
Текущие состояния расширения
- Босния и Герцеговина (BA)
Дата подачи или позднее: 1 декабря 2004 г.
Текущий сбор: 102 евро - Черногория (ME)
Дата подачи или позднее: 1 марта 2010 г.
Текущий сбор: 102 евро
Страны, которые ранее были государствами-членами, но теперь являются государствами-членами:
| Албания (AL) | Бывшая югославская Республика Македония (MK) |
| Хорватия (HR) | Румыния (RO) |
| Литва (LT) | Сербия (RS) |
| Латвия (LV) | Словения (SI) |
Текущие состояния проверки
- Марокко (MA)
Дата подачи: 1 марта 2015 г.